Аналіз впливу біологічно активних сполук вівса та люцерни в раціоні гусей на харчову цінність гусячого м’яса
DOI:
https://doi.org/10.15587/2706-5448.2023.289711Ключові слова:
м’ясо гусей, біологічно активні сполуки, овес посівний, люцерна, низькотемпературне зберігання, антиоксиданти, продукти пероксидного окиснення ліпідівАнотація
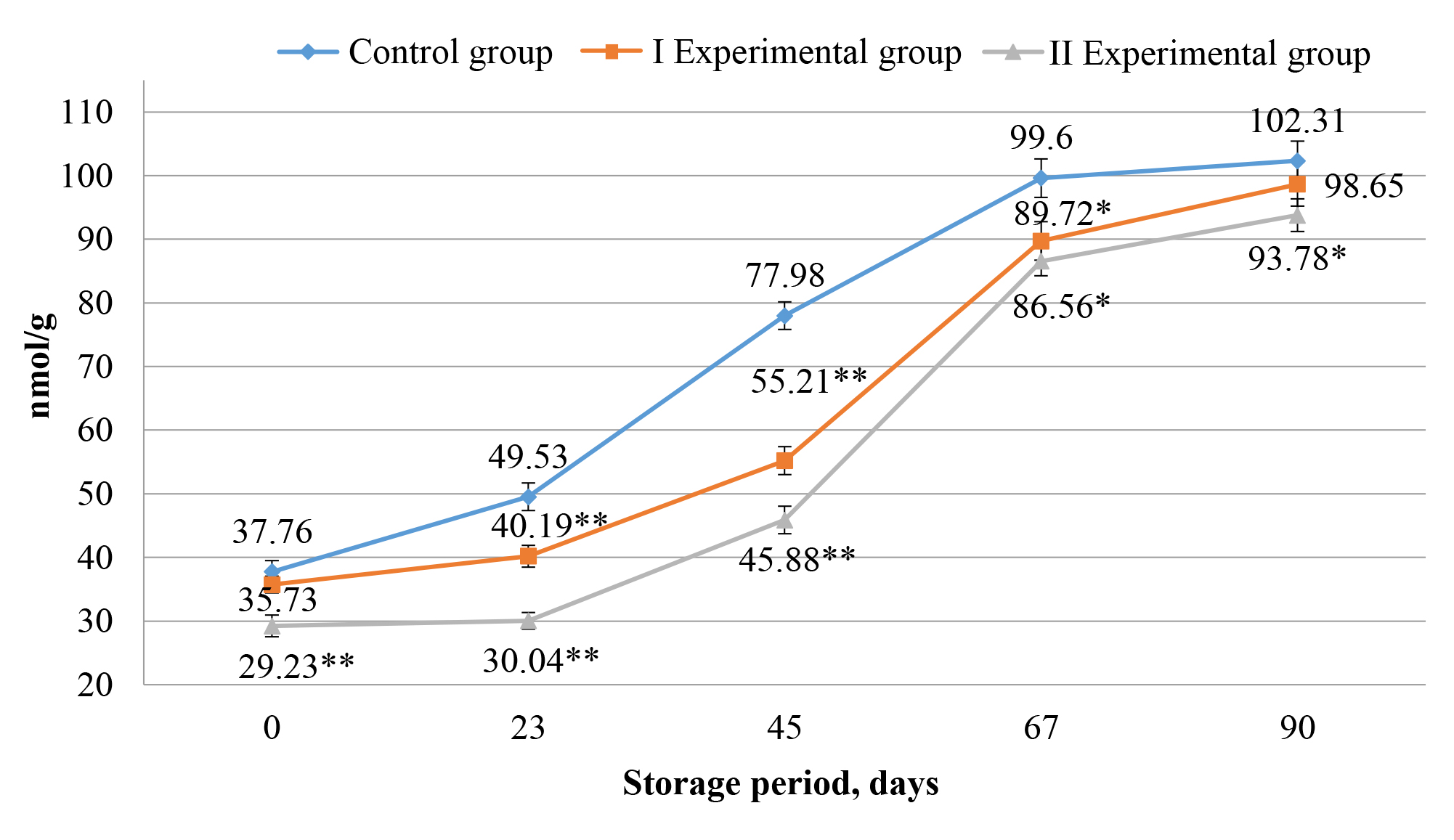
Досліджена доцільність введення до раціону гусей породи Легарт Датський домішок вівса (Avena Sativa) та люцерни (Medicago sativa) з метою покращення якості отриманого м’яса цієї птиці як після забою, так і після тривалого низькотемпературного зберігання шляхом підвищення його антиоксидантної активності. У роботі проаналізовано та обґрунтовано використання домішок вівса та люцерни в раціоні гусей. В результаті проведеного дослідження було встановлено, що додавання вівса (І дослідна група) і суміші вівса з люцерною (ІІ дослідна група) до раціону гусей сприяло зниженню вмісту кінцевих продуктів пероксидного окиснення ліпідів (ПОЛ) у м’ясі грудки після забою та під час його тривалого низькотемпературного зберігання (90 діб). У м'ясі гусей обох дослідних груп встановлено подовження терміну прооксидантно-антиоксидантної рівноваги до 23-ї доби. Найбільша різниця вмісту продуктів ПОЛ у м’ясі контрольної та обох дослідних груп була зафіксована на 45-ту добу зберігання м'яса. Для м'яса І дослідної групи ця різниця становила 29,2 %, для ІІ дослідної групи – 41,2 %. Максимальна інтенсивність процесів ПОЛ у м'ясі гусей обох дослідних груп була встановлена від 45-ї до 67-ї доби зберігання. За цей час у м'ясі гусей І дослідної групи вміст продуктів ПОЛ збільшився на 62,5 %, а ІІ – на 88,7 %. До 67-ої доби вміст продуктів ПОЛ у м'ясі контрольної групи достовірно перевищував відповідні показники дослідних груп. Наприкінці досліду вміст продуктів ПОЛ у м'ясі гусей контрольної та дослідних груп достовірно не відрізнявся. Аналіз жирнокислотного складу м'яса грудки гусей показав, що найбільш позитивні зміни відбулись у м'ясі гусей ІІ дослідної групи. На початку терміну зберігання у м'ясі цієї групи було виявлено збільшений вміст незамінних жирних кислот: лінолевої (18:2) на 11,4 %, ліноленової (18:3) на 25,8 % і арахідонової (20:4) на 12,4 %. Загальний вміст ω6-жирних кислот у м'ясі цієї групи виявився на 10,9 % вищим за відповідний показник контрольної групі. Втім, на 90-ту добу зберігання достовірної різниці за вмістом незамінних жирних кислот у м'ясі гусей ІІ дослідної і контрольної груп гусей не зафіксовано.
Посилання
- Orkusz, A., Wolańska, W., Krajinska, U. (2021). The Assessment of Changes in the Fatty Acid Profile and Dietary Indicators Depending on the Storage Conditions of Goose Meat. Molecules, 26 (17), 5122. doi: https://doi.org/10.3390/molecules26175122
- OECD-FAO Agricultural outlook, 2020–2029 (2020). OECD Publishing. doi: https://doi.org/10.1787/1112c23b-en
- Hafez, H. M., Attia, Y. A., Bovera, F., Abd El-Hack, M. E., Khafaga, A. F., de Oliveira, M. C. (2021). Influence of COVID-19 on the poultry production and environment. Environmental Science and Pollution Research, 28 (33), 44833–44844. doi: https://doi.org/10.1007/s11356-021-15052-5
- Attia, Y. A., Rahman, Md. T., Hossain, Md. J., Basiouni, S., Khafaga, A. F., Shehata, A. A., Hafez, H. M. (2022). Poultry Production and Sustainability in Developing Countries under the COVID-19 Crisis: Lessons Learned. Animals, 12 (5), 644. doi: https://doi.org/10.3390/ani12050644
- Kushch, M. M., Kushch, L. L., Byrka, E. V., Yaremchuk, O. S. (2019). Morphological features of the jejunum and ileum of the middle and heavy goose breeds. Ukrainian Journal of Ecology, 9 (4), 690–694. doi: https://doi.org/10.15421/2019_811
- Plys, V. M., Martynenko, H. N., Chukhlebova, A. S., Kolbasina, T. V. (2014). Influence of the antioxidant mixture on waterfowl muscle tissue resistance to oxidation. Veterynarna medytsyna, 98, 128–130. Available at: http://nbuv.gov.ua/UJRN/vetmed_2014_98_35
- Muzolf-Panek, M., Kaczmarek, A., Tomaszewska-Gras, J., Cegielska-Radziejewska, R., Szablewski, T., Majcher, M., Stuper-Szablewska, K. (2020). A Chemometric Approach to Oxidative Stability and Physicochemical Quality of Raw Ground Chicken Meat Affected by Black Seed and Other Spice Extracts. Antioxidants, 9 (9), 903. doi: https://doi.org/10.3390/antiox9090903
- Shen, M. M., Zhang, L. L., Chen, Y. N., Zhang, Y. Y., Han, H. L., Niu, Y. et al. (2019). Effects of bamboo leaf extract on growth performance, meat quality, and meat oxidative stability in broiler chickens. Poultry Science, 98 (12), 6787–6796. doi: https://doi.org/10.3382/ps/pez404
- Kim, I.-S., Hwang, C.-W., Yang, W.-S., Kim, C.-H. (2021). Multiple Antioxidative and Bioactive Molecules of Oats (Avena sativa L.) in Human Health. Antioxidants, 10 (9), 1454. doi: https://doi.org/10.3390/antiox10091454
- Pretorius, C. J., Dubery, I. A. (2023). Avenanthramides, Distinctive Hydroxycinnamoyl Conjugates of Oat, Avena sativa L.: An Update on the Biosynthesis, Chemistry, and Bioactivities. Plants, 12 (6), 1388. doi: https://doi.org/10.3390/plants12061388
- Leonova, S., Gnutikov, A., Loskutov, I., Blinova, E., Gustafsson, K.-E., Olsson, O. (2020). Diversity of avenanthramide content in wild and cultivated oats. Proceedings on Applied Botany, Genetics and Breeding, 181 (1), 30–47. doi: https://doi.org/10.30901/2227-8834-2020-1-30-47
- Mattioli, S., Dal Bosco, A., Castellini, C., Falcinelli, B., Sileoni, V., Marconi, O. et al. (2019). Effect of heat‐ and freeze‐drying treatments on phytochemical content and fatty acid profile of alfalfa and flax sprouts. Journal of the Science of Food and Agriculture, 99 (8), 4029–4035. doi: https://doi.org/10.1002/jsfa.9630
- Li, J., Zhang, S., Gu, X., Xie, J., Zhu, X., Wang, Y., Shan, T. (2022). Effects of alfalfa levels on carcass traits, meat quality, fatty acid composition, amino acid profile, and gut microflora composition of Heigai pigs. Frontiers in Nutrition, 9. doi: https://doi.org/10.3389/fnut.2022.975455
- Ionov, I. A., Shapovalov, S. O., Rudenko, E. V. (2011). Kriterii i metody kontrolia metabolizma v organizme zhivotnykh i ptitc. Kharkiv, 376.
- Bligh, E. G., Dyer, W. J. (1959). A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology, 37 (8), 911–917. doi: https://doi.org/10.1139/o59-099
- Palmer, F. B. St. C. (1971). The extraction of acidic phospholipids in organic solvent mixtures containing water. Biochimica et Biophysica Acta (BBA) – Lipids and Lipid Metabolism, 231 (1), 134–144. doi: https://doi.org/10.1016/0005-2760(71)90261-x
- Everitt, B. S., Landau, S. (2003). A Handbook of Statistical Analyses Using SPSS. Chapman & Hall/CRC, 368.
- Alemayehu, G. F., Forsido, S. F., Tola, Y. B., Amare, E. (2023). Nutritional and Phytochemical Composition and Associated Health Benefits of Oat (Avena sativa) Grains and Oat-Based Fermented Food Products. The Scientific World Journal, 2023, 1–16. doi: https://doi.org/10.1155/2023/2730175
- Francis, H., Debs, E., Koubaa, M., Alrayess, Z., Maroun, R. G., Louka, N. (2022). Sprouts Use as Functional Foods. Optimization of Germination of Wheat (Triticum aestivum L.), Alfalfa (Medicago sativa L.), and Radish (Raphanus sativus L.) Seeds Based on Their Nutritional Content Evolution. Foods, 11 (10), 1460. doi: https://doi.org/10.3390/foods11101460
- Horvat, D., Viljevac Vuletić, M., Andrić, L., Baličević, R., Kovačević Babić, M., Tucak, M. (2022). Characterization of Forage Quality, Phenolic Profiles, and Antioxidant Activity in Alfalfa (Medicago sativa L.). Plants, 11 (20), 2735. doi: https://doi.org/10.3390/plants11202735
- Danchenko, O. O., Nicolaeva, Y. V., Koshelev, O. I., Danchenko, M. M., Yakoviichuk, O. V., Halko, T. I. (2021). Effect of extract from common oat on the antioxidant activity and fatty acid composition of the muscular tissues of geese. Regulatory Mechanisms in Biosystems, 12 (2), 307–314. doi: https://doi.org/10.15421/022141
- Kovalev, S. V., Demeshko, O. V., Kocherga, V. Ya., Kovalev, V. M. (2017). The research of the organic acids of Medicago varia herb. Ukrainian biopharmaceutical journal, 3 (50), 52–55. doi: https://doi.org/10.24959/ubphj.17.118
- Opanasenko, M. M., Kalytka, V. V., Danchenko, O. O. (2010). State of the enzymatic part of system of antioxidatic protection of poultry meat at low-temperature storag. Tekhnolohiia vyrobnytstva i pererobky produktsii tvarynnytstva, 2 (70), 85–89. Available at: https://btsau.edu.ua/sites/default/files/visnyky/tehnologi%2070.pdf#page=85
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2023 Daniil Maiboroda, Olena Danchenko

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Закріплення та умови передачі авторських прав (ідентифікація авторства) здійснюється у Ліцензійному договорі. Зокрема, автори залишають за собою право на авторство свого рукопису та передають журналу право першої публікації цієї роботи на умовах ліцензії Creative Commons CC BY. При цьому вони мають право укладати самостійно додаткові угоди, що стосуються неексклюзивного поширення роботи у тому вигляді, в якому вона була опублікована цим журналом, але за умови збереження посилання на першу публікацію статті в цьому журналі.








