Вплив порушень метаболізму заліза, трансфузійного навантаження та застосування стимуляторів еритропоезу на якість життя, толерантність до терапії й довготривалу виживаність пацієнтів із хронічною мієлоїдною лейкемією після алогенної трансплантації стовбурових клітин
DOI:
https://doi.org/10.15587/2519-4798.2025.340317Ключові слова:
хронічна мієлоїдна лейкемія, алогенна трансплантація стовбурових клітин, перевантаження залізом, феритин, магнітно-резонансна томографія печінки, деферазирокс, стимулятори еритропоезу, еритропоетин, якість життя, виживаністьАнотація
Мета. Проаналізувати вплив перевантаження залізом, трансфузійного навантаження та застосування стимуляторів еритропоезу (СЕП) на якість життя, толерантність до терапії й довготривалу виживаність пацієнтів із хронічною мієлоїдною лейкемією (ХМЛ) після алогенної трансплантації гемопоетичних стовбурових клітин (ало-ТГСК), узагальнити патофізіологічні механізми та клінічні наслідки, сформувати практичні рекомендації.
Матеріали та методи. Наративний огляд сучасної літератури (2006–2025) з пошуком у PubMed/PMC та аналізом настанов ELN, NCCN, ESMO, даних реєстрів і проспективних/ретроспективних досліджень щодо: ролі ало-ТГСК в еру інгібіторів тирозинкіназ, біології перевантаження залізом (ПЗ) і маркерів (феритин, LIC за МРТ), ефективності хелаторів (деферазирокс) та СЕП (рекомбінантний еритропоетин), а також посттрансплантаційних стратегій (TKI-підтримка). Критеріями релевантності були: популяції CML або змішані когорти після ТГСК з окремим аналізом CML; наявність «твердих» кінцевих точок (ЗВ, ВБП, НРС, рецидив), показників якості життя та безпеки.
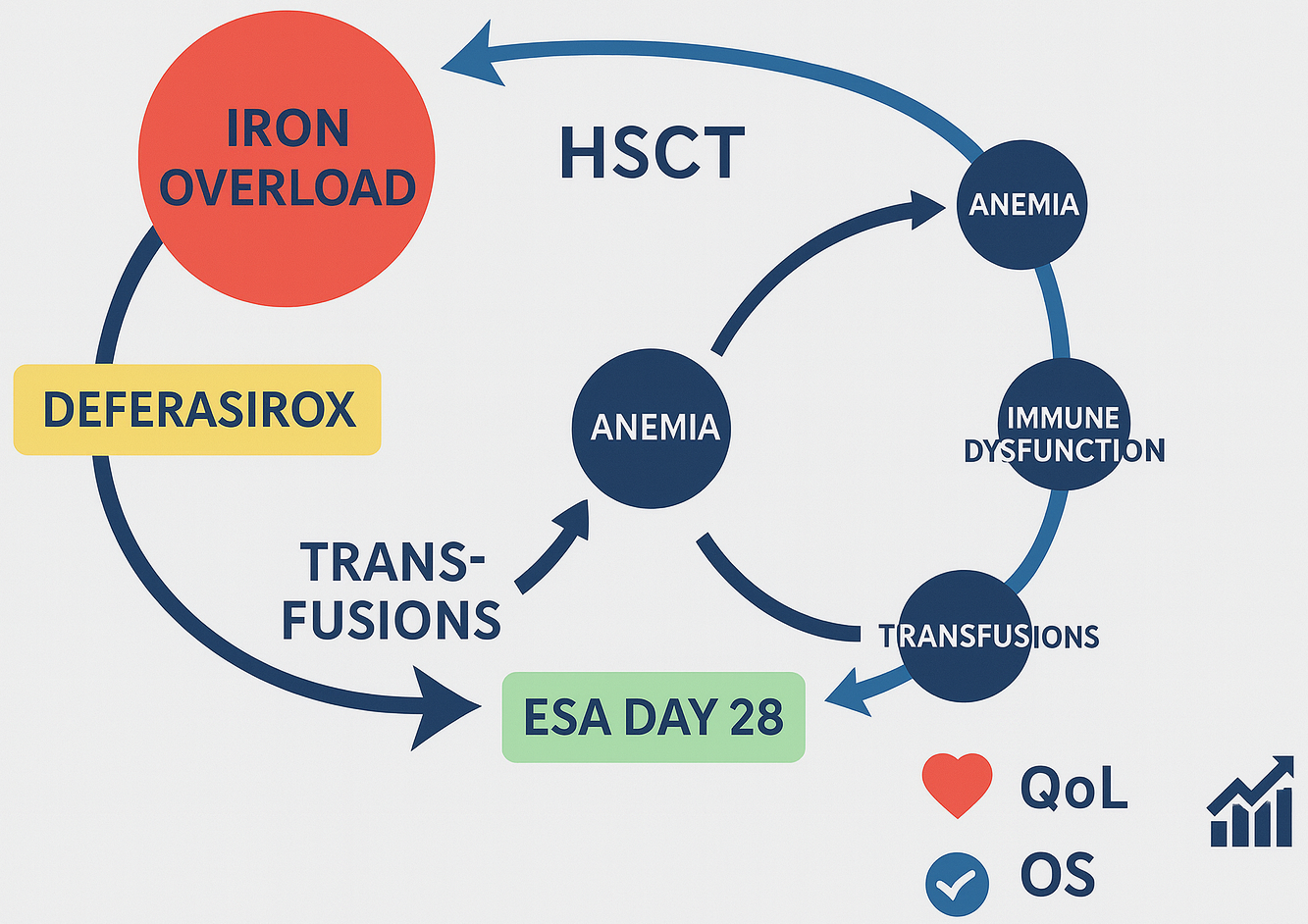
Результати. Ало-ТГСК у CML нині показана переважно при невдачі ≥2 ліній ІТК або у фазах акселерації/бластного кризу; прогноз суттєво залежить від фази на момент ТГСК (найкращі показники в ХФ). ПЗ формується через масивні гемотрансфузії, цитоліз і запалення; феритин – зручний, але запально-залежний маркер, тоді як LIC за МРТ точніше відбиває депо-залізо. Надлишок заліза має імуномодулюючі ефекти (зниження CD4/CD8, дисфункція NK, пригнічення фагоцитозу), що послаблює ефект «трансплантат проти лейкемії», підвищуючи ризик рецидиву, інвазивних інфекцій та SOS-синдрому. Гіперферитинемія перед/після ТГСК асоціюється з гіршою виживаністю, хоча частка ризику зумовлена супутнім системним запаленням; поєднане вимірювання феритину та LIC/СРБ підвищує прогностичну точність. Деферазирокс знижує феритин і LIC, а в низці досліджень пов’язаний із кращою ЗВ/ВБП за рахунок зменшення рецидивів; можливий механізм – «розблокування» GVL (зменшення Tregs, збереження NK), що інколи супроводжується вищою частотою хронічної РТПХ. СЕП, розпочаті після відновлення еритропоезу (≈день 28), прискорюють корекцію Hb і зменшують потребу в трансфузіях; початок «з нуля» ефекту не дає. Інтегративна модель підкреслює взаємопов’язані петлі: «ТГСК→анемія→трансфузії→ПЗ→імунодисфункція→рецидив/інфекції», які можна модулювати хелацією, своєчасним призначенням СЕП та ризик-адаптованою підтримкою TKI.
Висновки. Оптимізація результатів ало-ТГСК у CML потребує системного менеджменту ПЗ та анемії: 1) стратифікація ризику з урахуванням фази CML, феритину разом із СРБ і/або LIC; 2) розгляд деферазироксу при персистуючій гіперферитинемії/високому LIC з моніторингом ниркової функції; 3) відтермінований старт СЕП (близько 4-го тижня) за наявності неадекватної ендогенної відповіді та доступності заліза; 4) селективна посттрансплантаційна TKI-підтримка. Потрібні великі РКД із «твердими» кінцевими точками, які розмежують внесок заліза та запалення і визначать оптимальні алгоритми хелації та еритропоетинової терапії з урахуванням впливу на ЯЖ, рецидиви й ЗВ
Посилання
- Cross, N. C. P., Ernst, T., Branford, S., Cayuela, J.-M., Deininger, M., Fabarius, A. et al. (2023). European LeukemiaNet laboratory recommendations for the diagnosis and management of chronic myeloid leukemia. Leukemia, 37 (11), 2150–2167. https://doi.org/10.1038/s41375-023-02048-y
- Hochhaus, A., Baccarani, M., Silver, R. T., Schiffer, C., Apperley, J. F., Cervantes, F. et al. (2020). European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia, 34 (4), 966–984. https://doi.org/10.1038/s41375-020-0776-2
- Shah, N. P., Bhatia, R., Altman, J. K., Amaya, M., Begna, K. H., Berman, E. et al. (2024). Chronic Myeloid Leukemia, Version 2.2024, NCCN Clinical Practice Guidelines in Oncology. Journal of the National Comprehensive Cancer Network, 22 (1), 43–69. https://doi.org/10.6004/jnccn.2024.0007
- Jabbour, E., Kantarjian, H. (2025). Chronic Myeloid Leukemia. JAMA, 333 (18), 1618. https://doi.org/10.1001/jama.2025.0220
- Patra, P. C., Rainchwar, S., Singh, R., Bhatia, N., Bhatnagar, S., Palatty, R. J. et al. (2025). Allogeneic transplantation for CML blast phase: Learnings over last decade from a single centre in North India. Annals of Hematology, 104 (4), 2483–2493. https://doi.org/10.1007/s00277-025-06350-w
- Ju, H. Y., Choi, H. S., Park, H. J., Yoo, K. H., Lyu, C. J., Im, H. J. et al. (2025). Allogeneic Hematopoietic Stem Cell Transplantation in Pediatric and Young Adult Patients with Chronic Myeloid Leukemia in Tyrosine Kinase Inhibitor Era: A Study of the Korean Blood and Marrow Transplantation Registry. Cancer Research and Treatment. https://doi.org/10.4143/crt.2024.1186
- Chalandon, Y., Simonetta, F., Masouridi-Levrat, S. (2025). How I approach hematopoietic stem cell transplantation for CML in a TKI world. Blood Journal. https://doi.org/10.1182/blood.2024026512
- Chalandon, Y., Sbianchi, G., Gras, L., Koster, L., Apperley, J., Byrne, J. et al. (2022). Allogeneic hematopoietic cell transplantation in patients with chronic phase chronic myeloid leukemia in the era of third generation tyrosine kinase inhibitors: A retrospective study by the chronic malignancies working party of the EBMT. American Journal of Hematology, 98 (1), 112–121. https://doi.org/10.1002/ajh.26764
- Von dem Borne, P., Beaumont, F., Starrenburg, C., Oudshoorn, M., Hale, G., Falkenburg, J. et al. (2006). Outcomes after myeloablative unrelated donor stem cell transplantation using both in vitro and in vivo T-cell depletion with alemtuzumab. Haematologica, 91, 1559–1562.
- Atilla, E., Toprak, S. K., Demirer, T. (2017). Current Review of Iron Overload and Related Complications in Hematopoietic Stem Cell Transplantation. Turkish Journal of Hematology, 34 (1), 1–9. https://doi.org/10.4274/tjh.2016.0450
- Pullarkat, V., Blanchard, S., Tegtmeier, B., Dagis, A., Patane, K., Ito, J., Forman, S. J. (2008). Iron overload adversely affects outcome of allogeneic hematopoietic cell transplantation. Bone Marrow Transplantation, 42 (12), 799–805. https://doi.org/10.1038/bmt.2008.262
- Adams, R. L. C., Bird, R. J. (2013). Safety and efficacy of deferasirox in the management of transfusion-dependent patients with myelodysplastic syndrome and aplastic anaemia: a perspective review. Therapeutic Advances in Hematology, 4 (2), 93–102. https://doi.org/10.1177/2040620712472355
- Vallejo, C., Batlle, M., Vazquez, L., Solano, C., Sampol, A., Duarte, R. et al. (2014). Phase IV open-label study of the efficacy and safety of deferasirox after allogeneic stem cell transplantation. Haematologica, 99 (10), 1632–1637. https://doi.org/10.3324/haematol.2014.105908
- Cho, B., Jeon, Y., Hahn, A., Lee, T., Park, S., Yoon, J. et al. (2019). Improved survival outcomes and restoration of graft‐vs‐leukemia effect by deferasirox after allogeneic stem cell transplantation in acute myeloid leukemia. Cancer Medicine, 8 (2), 501–514. https://doi.org/10.1002/cam4.1928
- Jaspers, A., Baron, F., Willems, É., Seidel, L., Hafraoui, K., Vanstraelen, G. et al. (2014). Erythropoietin therapy after allogeneic hematopoietic cell transplantation: a prospective, randomized trial. Blood, 124 (1), 33–41. https://doi.org/10.1182/blood-2014-01-546333
- Pirotte, M., Fillet, M., Seidel, L., Jaspers, A., Baron, F., Beguin, Y. (2021). Erythroferrone and hepcidin as mediators between erythropoiesis and iron metabolism during allogeneic hematopoietic stem cell transplant. American Journal of Hematology, 96 (10), 1275–1286. https://doi.org/10.1002/ajh.26300
- Cserti-Gazdewich, C. (2018). Shifting ground and gaps in transfusion support of patients with hematological malignancies. Hematology, 2018 (1), 553–560. https://doi.org/10.1182/asheducation-2018.1.553
- Panch, S. R., Yau, Y. Y., West, K., Diggs, K., Sweigart, T., Leitman, S. F. (2014). Initial serum ferritin predicts number of therapeutic phlebotomies to iron depletion in secondary iron overload. Transfusion, 55 (3), 611–622. https://doi.org/10.1111/trf.12854
- Guan, X.-Z., Wang, L.-L., Pan, X., Liu, L., Sun, X.-L., Zhang, X.-J., Wang, D.-Q., Yu, Y. (2020). Clinical Indications of Recombinant Human Erythropoietin in a Single Center: A 10-Year Retrospective Study. Frontiers in Pharmacology, 11. https://doi.org/10.3389/fphar.2020.01110
- Sligar, C., Tomasiello, N. R., Cuthbertson, P., Nelson, T. L., Elhage, A., Sluyter, R., Watson, D. (2025). Use of Human Chronic Myeloid Leukemia Cells to Study Graft-Versus-Leukemia Immunity in a Xenogeneic Mouse Model of Graft-Versus-Host Disease. Graft-Versus-Host Disease, 2907, 333–358. https://doi.org/10.1007/978-1-0716-4430-0_16
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2025 Halyna Moroz

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.
Автори, які публікуються у цьому журналі, погоджуються з наступними умовами:
1. Автори залишають за собою право на авторство своєї роботи та передають журналу право першої публікації цієї роботи на умовах ліцензії Creative Commons CC BY, котра дозволяє іншим особам вільно розповсюджувати опубліковану роботу з обов'язковим посиланням на авторів оригінальної роботи та першу публікацію роботи у цьому журналі.
2. Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження роботи у тому вигляді, в якому вона була опублікована цим журналом (наприклад, розміщувати роботу в електронному сховищі установи або публікувати у складі монографії), за умови збереження посилання на першу публікацію роботи у цьому журналі.









