Клінічна ефективність симбіотичного препарату – Лотарді-А в комплексній терапії хворих із синдромом подразненого кишечника при метаболічно-асоційованій жировій хворобі печінки
DOI:
https://doi.org/10.15587/2519-4798.2025.329828Ключові слова:
неалкогольна жирова хвороба печінки/метаболічно-асоційована жирова хвороба печінки, синдром подразненої товстої кишки, ожиріння, метаболічні порушення, мікробіом, діагностика, лікування (пробіотики)Анотація
Синдром подразненого кишечника (СПК) та метаболічно асоційована жирова хвороба печінки (МАЖХП) є одними з найпоширеніших захворювань шлунково-кишкового тракту та печінки, що зустрічаються у первинній та вторинній медичній допомозі
Мета дослідження – визначити клінічну ефективність лікування із використанням симбіотичного препарату Лотарді-А в комплексній терапії хворих з СПК при МАЖХП.
Матеріали та методи. В наукове дослідження включено 60 хворих з СПК при МАЖХП. Хворих з СПК у поєднанні із МАЖХП розподілено на дві групи, залежно від методу лікування. Перша групи пацієнтів (І група – n= 30) отримували лише базисну терапію, спрямоване на корекцію функціонального стану кишечника та печінки. Друга група хворих (ІІ група – n= 30), додатково до базисного лікування отримували симбіотичний препарат Лотарді-А.
Результати досліджень. Додаткове призначення обстеженим пацієнтам симбіотика Лотарді-А сприяло позитивним змінам у кількісному та якісному складі мікрофлори товстої кишки. Визначено значне достовірне збільшення кількості Bifidobacterium, Lactobacillus. Оцінка динаміки біохімічних показників крові після лікування, що вказують на функціональний стан печінки у хворих з СПК при МАЖХП підтверджує більш виражені позитивні зміни в лабораторних показниках холестатичного синдрому в ІІ групі обстежуваних пацієнтів. Встановлено також достовірне зменшення ознак цитолітичного синдрому.
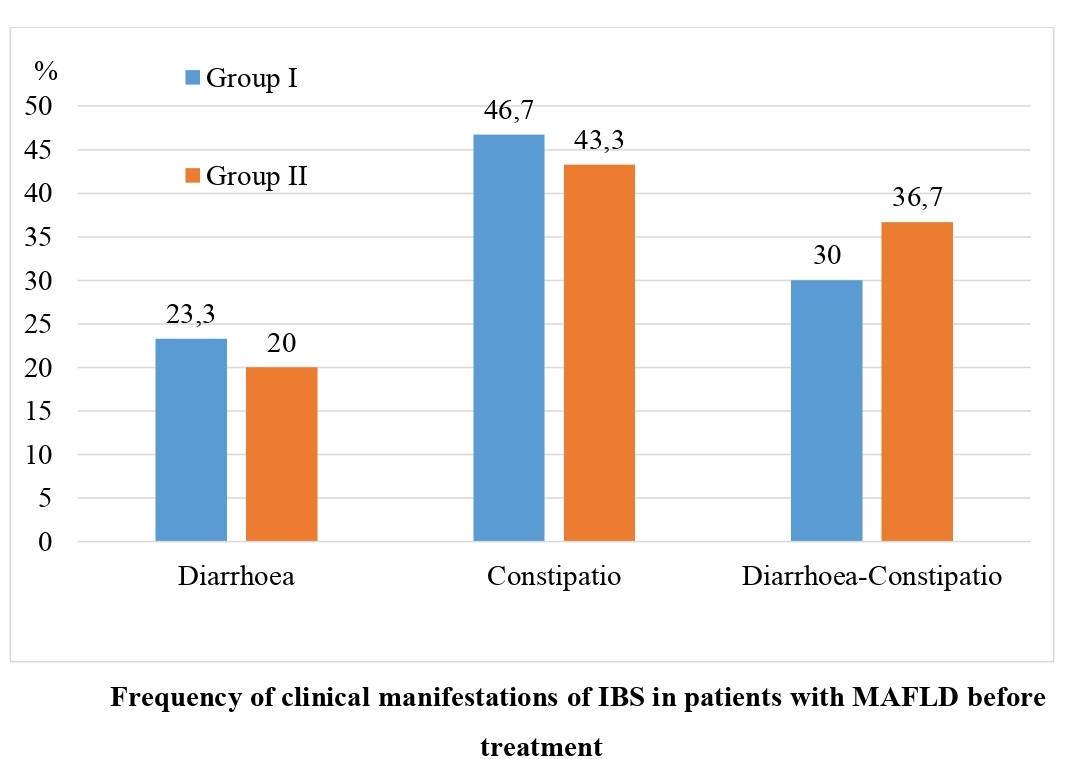
Висновки: У хворих на МАЖХП СПК клінічно частіше проявляється закрепом, а саме – у 43,3-46,7 % відповідно. Ці зміни виникають на фоні дисбіозу товстої кишки, переважно ІІ та І ст. (у 50,0 % та у 36,7-40,0 % обстежених).
Лікування хворих з СПК при МАЖХП має бути комплексним і включати пробіотичні препарати. Призначення препарату Лотарді-А є ефективним методом щодо корекції клінічних проявів СПК, а також є необхідним компонентом для лікування МАЖХП і корекції дисбіотичних змін. При цьому, у хворих І групи на НАЖХП та СПК із закрепами встановлено збільшення частоти акту дефекації на 30,0 % (р<0,01), тоді як у хворих І групи – лише на 10,0 % (р<0,05). У 26,7 % хворих ІІ групи після комплексного лікування дисбіоз при повторному дослідженні не виявлено, тоді як в І групі пацієнтів таких осіб нами не встановлено. Додаткове призначення симбіотичного комплексу хворим на СПК при НАЖХП є ефективним засобом комплексного лікування для зменшення вираженості порушень функціонального стану печінки й ліпідного обміну. При цьому, у хворих ІІ групи встановлено більш виражене достовірне зменшення активності АЛТ у сироватці крові (зменшення на 43,63±0,37 ОД/л – р<0,01). Така ж тенденція виявлено і при оцінці рівня тригліцеридів у сироватці крові (зменшення на 1,65±0,03 ммоль/л – р<0,01)
Посилання
- Purssell, H., Whorwell, P. J., Athwal, V. S., Vasant, D. H. (2021). Non-alcoholic fatty liver disease in irritable bowel syndrome: More than a coincidence? World Journal of Hepatology, 13 (12), 1816–1827. https://doi.org/10.4254/wjh.v13.i12.1816
- Oka, P., Parr, H., Barberio, B., Black, C. J., Savarino, E. V., Ford, A. C. (2020). Global prevalence of irritable bowel syndrome according to Rome III or IV criteria: a systematic review and meta-analysis. The Lancet Gastroenterology & Hepatology, 5 (10), 908–917. https://doi.org/10.1016/s2468-1253(20)30217-x
- Sperber, A. D., Dumitrascu, D., Fukudo, S., Gerson, C., Ghoshal, U. C., Gwee, K. A. et al. (2016). The global prevalence of IBS in adults remains elusive due to the heterogeneity of studies: a Rome Foundation working team literature review. Gut, 66 (6), 1075–1082. https://doi.org/10.1136/gutjnl-2015-311240
- Black, C. J., Ford, A. C. (2020). Global burden of irritable bowel syndrome: trends, predictions and risk factors. Nature Reviews Gastroenterology & Hepatology, 17 (8), 473–486. https://doi.org/10.1038/s41575-020-0286-8
- Targher, G., Byrne, C. D., Tilg, H. (2020). NAFLD and increased risk of cardiovascular disease: clinical associations, pathophysiological mechanisms and pharmacological implications. Gut, 69 (9), 1691–1705. https://doi.org/10.1136/gutjnl-2020-320622
- Cotter, T. G., Charlton, M. (2019). Nonalcoholic Steatohepatitis After Liver Transplantation. Liver Transplantation, 26 (1), 141–159. https://doi.org/10.1002/lt.25657
- Haldar, D., Kern, B., Hodson, J., Armstrong, M. J., Adam, R., Berlakovich, G. et al. (2019). Outcomes of liver transplantation for non-alcoholic steatohepatitis: A European Liver Transplant Registry study. Journal of Hepatology, 71 (2), 313–322. https://doi.org/10.1016/j.jhep.2019.04.011
- Holtmann, G. J., Ford, A. C., Talley, N. J. (2016). Pathophysiology of irritable bowel syndrome. The Lancet Gastroenterology & Hepatology, 1 (2), 133–146. https://doi.org/10.1016/s2468-1253(16)30023-1
- Khalil, Md. M., Munira, S., Alam, Md. M., Appolo, A. M., Sayeed, M. Md. A., Islam, A. et al. (2024). Prevalence of Nonalcoholic Fatty Liver Disease [NAFLD] and Metabolic dysfunction associated Fatty Liver Disease [MAFLD] in patients with Irritable Bowel Syndrome [IBS]. SN Comprehensive Clinical Medicine, 6 (1). https://doi.org/10.1007/s42399-024-01675-5
- Zeng, F., Su, X., Liang, X., Liao, M., Zhong, H., Xu, J. et al. (2024). Gut microbiome features and metabolites in non-alcoholic fatty liver disease among community-dwelling middle-aged and older adults. BMC Medicine, 22 (1). https://doi.org/10.1186/s12916-024-03317-y
- Safari, Z., Gérard, P. (2019). The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD). Cellular and Molecular Life Sciences, 76 (8), 1541–1558. https://doi.org/10.1007/s00018-019-03011-w
- Kolodziejczyk, A. A., Zheng, D., Shibolet, O., Elinav, E. (2019). The role of the microbiome in NAFLD and NASH. EMBO Molecular Medicine, 11 (2). https://doi.org/10.15252/emmm.201809302
- Canfora, E. E., Meex, R. C. R., Venema, K., Blaak, E. E. (2019). Gut microbial metabolites in obesity, NAFLD and T2DM. Nature Reviews Endocrinology, 15(5), 261–273. https://doi.org/10.1038/s41574-019-0156-z
- Chen, J., Vitetta, L. (2020). Gut Microbiota Metabolites in NAFLD Pathogenesis and Therapeutic Implications. International Journal of Molecular Sciences, 21 (15), 5214. https://doi.org/10.3390/ijms21155214
- Jiao, N., Baker, S. S., Chapa-Rodriguez, A., Liu, W., Nugent, C. A., Tsompana, M. et al. (2017). Suppressed hepatic bile acid signalling despite elevated production of primary and secondary bile acids in NAFLD. Gut, 67 (10), 1881–1891. https://doi.org/10.1136/gutjnl-2017-314307
- Brody, H. (2020). The gut microbiome. Nature, 577 (7792), S5–S5. https://doi.org/10.1038/d41586-020-00194-2
- Si, J., Lee, G., You, H. J., Joo, S. K., Lee, D. H., Ku, B. J. et al. (2021). Gut microbiome signatures distinguish type 2 diabetes mellitus from non-alcoholic fatty liver disease. Computational and Structural Biotechnology Journal, 19, 5920–5930. https://doi.org/10.1016/j.csbj.2021.10.032
- Iino, C., Endo, T., Mikami, K., Hasegawa, T., Kimura, M., Sawada, N. et al. (2019). Significant decrease in Faecalibacterium among gut microbiota in nonalcoholic fatty liver disease: a large BMI- and sex-matched population study. Hepatology International, 13 (6), 748–756. https://doi.org/10.1007/s12072-019-09987-8
- Lee, G., You, H. J., Bajaj, J. S., Joo, S. K., Yu, J., Park, S. et al. (2020). Distinct signatures of gut microbiome and metabolites associated with significant fibrosis in non-obese NAFLD. Nature Communications, 11 (1). https://doi.org/10.1038/s41467-020-18754-5
- Su, X., Chen, S., Liu, J., Feng, Y., Han, E., Hao, X. et al. (2023). Composition of gut microbiota and non‐alcoholic fatty liver disease: A systematic review and meta‐analysis. Obesity Reviews, 25 (1). https://doi.org/10.1111/obr.13646
- Cammarota, G., Ianiro, G., Ahern, A., Carbone, C., Temko, A., Claesson, M. J. et al. (2020). Gut microbiome, big data and machine learning to promote precision medicine for cancer. Nature Reviews Gastroenterology & Hepatology, 17 (10), 635–648. https://doi.org/10.1038/s41575-020-0327-3
- Chong, P. P., Chin, V. K., Looi, C. Y., Wong, W. F., Madhavan, P., Yong, V. C. (2019). The Microbiome and Irritable Bowel Syndrome – A Review on the Pathophysiology, Current Research and Future Therapy. Frontiers in Microbiology, 10. https://doi.org/10.3389/fmicb.2019.01136
- Enck, P., Aziz, Q., Barbara, G., Farmer, A. D., Fukudo, S., Mayer, E. A. et al. (2016). Irritable bowel syndrome. Nature Reviews Disease Primers, 2 (1). https://doi.org/10.1038/nrdp.2016.14
- Menees, S., Chey, W. (2018). The gut microbiome and irritable bowel syndrome. F1000Research, 7, 1029. https://doi.org/10.12688/f1000research.14592.1
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2025 Yelyzaveta Sirchak

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.
Автори, які публікуються у цьому журналі, погоджуються з наступними умовами:
1. Автори залишають за собою право на авторство своєї роботи та передають журналу право першої публікації цієї роботи на умовах ліцензії Creative Commons CC BY, котра дозволяє іншим особам вільно розповсюджувати опубліковану роботу з обов'язковим посиланням на авторів оригінальної роботи та першу публікацію роботи у цьому журналі.
2. Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження роботи у тому вигляді, в якому вона була опублікована цим журналом (наприклад, розміщувати роботу в електронному сховищі установи або публікувати у складі монографії), за умови збереження посилання на першу публікацію роботи у цьому журналі.









