Нейрогормональні зміни та порушення бар’єрної функцію кишечника при синдромі подразненої кишки у хворих на метаболічно-асоційовану жирову хворобу печінки та їх корекція
DOI:
https://doi.org/10.15587/2519-4798.2025.332826Ключові слова:
неалкогольна жирова хвороба печінки/метаболічно-асоційована жирова хвороба печінки, синдром подразненої товстої кишки, нейрогормони (серотонін, мелатонін), бар’єрна функція кишечника, нейропсихометричні тести, пробіотикАнотація
Дослідження нейропсихометричних порушень у хворих з синдромом подразненого кишечника (СПК) у поєднанні з метабоілчно-асоційованою жировою хворобою печінки (МАЖХП) може розширити діагностичні аспекти та можливості лікування хворих із поєднаною патологією.
Мета дослідження – оцінити вплив порушення рівня нейрогормонів та бар’єрної функції кишечника на нейропсихометричні зміни у хворих з СПК при МАЖХП та їх корекція.
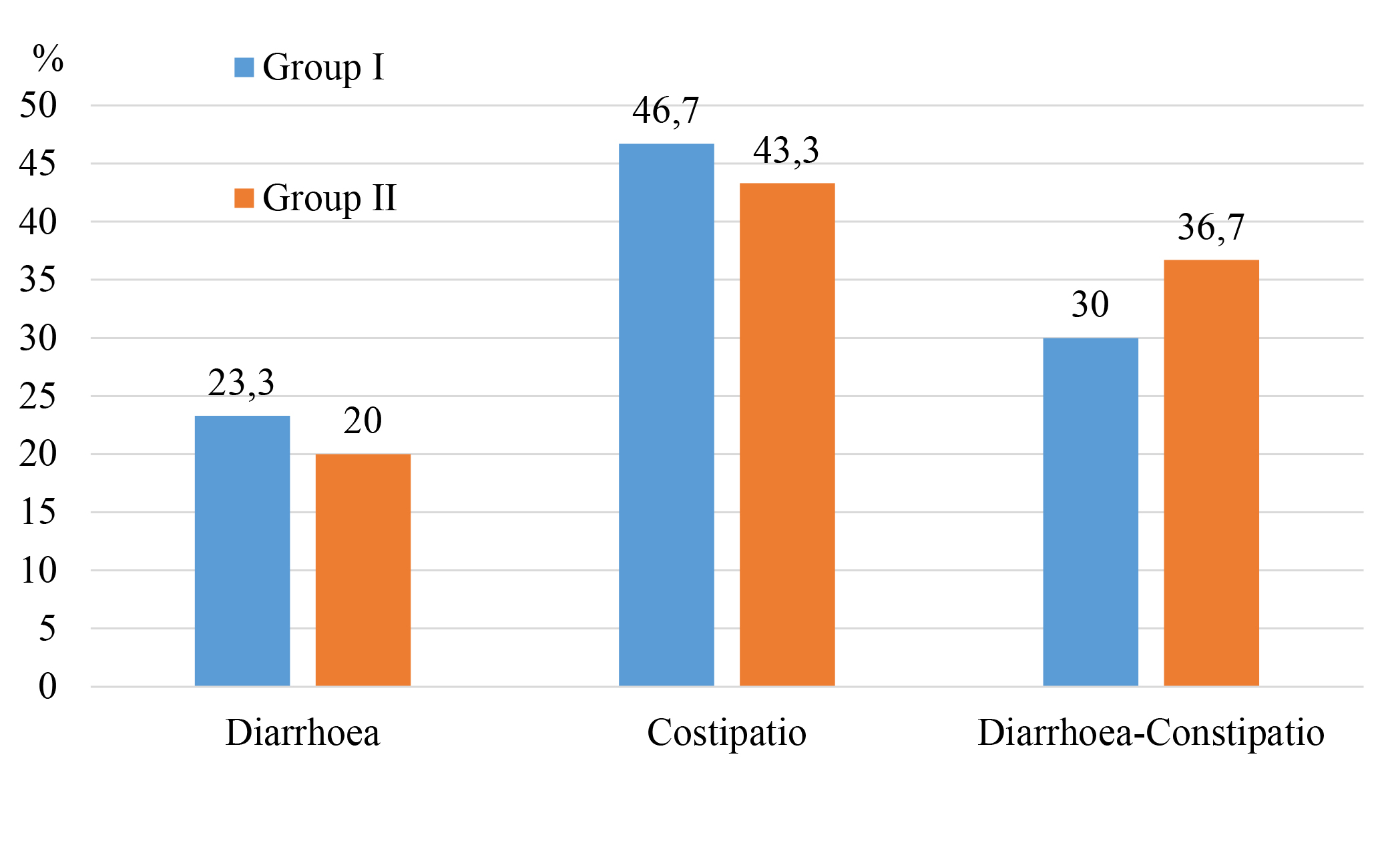
Матеріали та методи. Обстежено 60 хворих з СПК при МАЖХП. Визначено рівень мелатоніну (МТ) та серотоніну (СТ) у сироватці крові. Оцінено показник α1-антитрипсину (α1-АТ) та зонуліну у сироватці крові та калі у обстежених хворих. Хворих розподілено на дві групи. Перша групи пацієнтів (n= 30) отримували лише базисну терапію. Друга група хворих (n= 30), додатково до базисного лікування отримували симбіотичний препарат Lothardi A. Обстеженим проведено визначення порушення функції центральної нервової системи (шкала самооцінки Спілберга та Ханіна; шкала депресії Бека; шкала Занга; Торонтська Алекситимічна шкала).
Результати досліджень. Отримані результати підтверджують позитивний ефект Лотарді А щодо покращення проникності кишкового бар’єру, й рівня нейрогормонів у сироватці крові при СПК та МАЖХП. Також визначається виражена позитивна динаміка у показниках нейропсимотречного стану в даних хворих.
Висновки: У хворих з СПК при МАЖХП діагностовано зміни рівня СТ та МТ у сироватці крові, що корелюють з вираженістю порушення бар’єрної функції кишечника. У хворих на СПК при МАЖХП виявлено порушення нейропсихометричного статусу. Курсове призначення Лотарді-А в складі комплексної терапії хворим на СПК при МАЖХП є патогенетично обгрунтованим і призводить не лише до покращення клінічної симптоматики, а й і сприяє покращенню дисбіотичних змін, порушеної бар’єрної функції кишечника, нормалізації рівня СТ, МТ у сироватці крові, що є передумовою для покращення психічного статусу в даних хворих
Посилання
- Shaikh, S. D., Sun, N., Canakis, A., Park, W. Y., Weber, H. C. (2023). Irritable Bowel Syndrome and the Gut Microbiome: A Comprehensive Review. Journal of Clinical Medicine, 12 (7), 2558. https://doi.org/10.3390/jcm12072558
- Sperber, A. D., Bangdiwala, S. I., Drossman, D. A., Ghoshal, U. C., Simren, M., Tack, J. et al. (2021). Worldwide Prevalence and Burden of Functional Gastrointestinal Disorders, Results of Rome Foundation Global Study. Gastroenterology, 160 (1), 99–114.e3. https://doi.org/10.1053/j.gastro.2020.04.014
- Sperber, A. D., Dumitrascu, D., Fukudo, S., Gerson, C., Ghoshal, U. C., Gwee, K. A., Hungin, A. P. S. et al. (2016). The global prevalence of IBS in adults remains elusive due to the heterogeneity of studies: a Rome Foundation working team literature review. Gut, 66 (6), 1075–1082. https://doi.org/10.1136/gutjnl-2015-311240
- Purssell, H., Whorwell, P. J., Athwal, V. S., Vasant, D. H. (2021). Non-alcoholic fatty liver disease in irritable bowel syndrome: More than a coincidence? World Journal of Hepatology, 13 (12), 1816–1827. https://doi.org/10.4254/wjh.v13.i12.1816
- Oka, P., Parr, H., Barberio, B., Black, C. J., Savarino, E. V., Ford, A. C. (2020). Global prevalence of irritable bowel syndrome according to Rome III or IV criteria: a systematic review and meta-analysis. The Lancet Gastroenterology & Hepatology, 5 (10), 908–917. https://doi.org/10.1016/s2468-1253(20)30217-x
- Staudacher, H. M., Black, C. J., Teasdale, S. B., Mikocka-Walus, A., Keefer, L. (2023). Irritable bowel syndrome and mental health comorbidity – approach to multidisciplinary management. Nature Reviews Gastroenterology & Hepatology, 20 (9), 582–596. https://doi.org/10.1038/s41575-023-00794-z
- Zamani, M., Alizadeh‐Tabari, S., Zamani, V. (2019). Systematic review with meta‐analysis: the prevalence of anxiety and depression in patients with irritable bowel syndrome. Alimentary Pharmacology & Therapeutics, 50 (2), 132–143. https://doi.org/10.1111/apt.15325
- Liu, Q., He, H., Yang, J., Feng, X., Zhao, F., Lyu, J. (2020). Changes in the global burden of depression from 1990 to 2017: Findings from the Global Burden of Disease study. Journal of Psychiatric Research, 126, 134–140. https://doi.org/10.1016/j.jpsychires.2019.08.002
- Black, C. J., Ford, A. C. (2020). Global burden of irritable bowel syndrome: trends, predictions and risk factors. Nature Reviews Gastroenterology & Hepatology, 17 (8), 473–486. https://doi.org/10.1038/s41575-020-0286-8
- Younossi, Z. M., Golabi, P., Paik, J. M., Henry, A., Van Dongen, C., Henry, L. (2023). The global epidemiology of nonalcoholic fatty liver disease (NAFLD) and nonalcoholic steatohepatitis (NASH): a systematic review. Hepatology, 77 (4), 1335–1347. https://doi.org/10.1097/hep.0000000000000004
- Tinajero, M. G., Malik, V. S. (2021). An Update on the Epidemiology of Type 2 Diabetes. Endocrinology and Metabolism Clinics of North America, 50 (3), 337–355. https://doi.org/10.1016/j.ecl.2021.05.013
- Lin, X., Xu, Y., Pan, X., Xu, J., Ding, Y., Sun, X. (2020). Global, regional, and national burden and trend of diabetes in 195 countries and territories: an analysis from 1990 to 2025. Scientific Reports, 10 (1). https://doi.org/10.1038/s41598-020-71908-9
- Golabi, P., Otgonsuren, M., de Avila, L., Sayiner, M., Rafiq, N., Younossi, Z. M. (2018). Components of metabolic syndrome increase the risk of mortality in nonalcoholic fatty liver disease (NAFLD). Medicine, 97 (13), e0214. https://doi.org/10.1097/md.0000000000010214
- Powell, E. E., Wong, V. W.-S., Rinella, M. (2021). Non-alcoholic fatty liver disease. The Lancet, 397 (10290), 2212–2224. https://doi.org/10.1016/s0140-6736(20)32511-3
- Xiong, R.-G., Li, J., Cheng, J., Zhou, D.-D., Wu, S.-X., Huang, S.-Y. et al. (2023). The Role of Gut Microbiota in Anxiety, Depression, and Other Mental Disorders as Well as the Protective Effects of Dietary Components. Nutrients, 15 (14), 3258. https://doi.org/10.3390/nu15143258
- Fasano, A. (2020). All disease begins in the (leaky) gut: role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Research, 9, 69. https://doi.org/10.12688/f1000research.20510.1
- Mörkl, S., Lackner, S., Meinitzer, A., Mangge, H., Lehofer, M., Halwachs, B. et al. (2018). Gut microbiota, dietary intakes and intestinal permeability reflected by serum zonulin in women. European Journal of Nutrition, 57 (8), 2985–2997. https://doi.org/10.1007/s00394-018-1784-0
- Kwon, J., Lee, H. G., Seo, K., Kim, H. (2018). Combination of Whole Grapeseed Flour and Newly Isolated Kefir Lactic Acid Bacteria Reduces High‐Fat‐Induced Hepatic Steatosis. Molecular Nutrition & Food Research, 63(4). Portico. https://doi.org/10.1002/mnfr.201801040
- Ohlsson, B., Orho-Melander, M., Nilsson, P. (2017). Higher Levels of Serum Zonulin May Rather Be Associated with Increased Risk of Obesity and Hyperlipidemia, Than with Gastrointestinal Symptoms or Disease Manifestations. International Journal of Molecular Sciences, 18 (3), 582. https://doi.org/10.3390/ijms18030582
- Barbaro, M. R., Cremon, C., Morselli-Labate, A. M., Di Sabatino, A., Giuffrida, P., Corazza, G. R. et al. (2020). Serum zonulin and its diagnostic performance in non-coeliac gluten sensitivity. Gut, 69 (11), 1966–1974. https://doi.org/10.1136/gutjnl-2019-319281
- Singh, P., Silvester, J., Chen, X., Xu, H., Sawhney, V., Rangan, V., Iturrino, J. et al. (2019). Serum zonulin is elevated in IBS and correlates with stool frequency in IBS‐D. United European Gastroenterology Journal, 7 (5), 709–715. https://doi.org/10.1177/2050640619826419
- Asmar, R. E., Panigrahi, P., Bamford, P., Berti, I., Not, T., Coppa, G. V. et al. (2002). Host-dependent zonulin secretion causes the impairment of the small intestine barrier function after bacterial exposure. Gastroenterology, 123 (5), 1607–1615. https://doi.org/10.1053/gast.2002.36578
- Ko, M., Kamimura, K., Owaki, T., Nagoya, T., Sakai, N., Nagayama, I. et al. (2021). Modulation of serotonin in the gut-liver neural axis ameliorates the fatty and fibrotic changes in non-alcoholic fatty liver. Disease Models & Mechanisms, 14 (3). https://doi.org/10.1242/dmm.048922
- Namkung, J., Shong, K. E., Kim, H., Oh, C.-M., Park, S., Kim, H. (2018). Inhibition of Serotonin Synthesis Induces Negative Hepatic Lipid Balance. Diabetes & Metabolism Journal, 42 (3), 233–243. https://doi.org/10.4093/dmj.2017.0084
- Atallah, M. A. A., Elaidy, S. M., Tawfik, M. K. (2018). Assessment of the possible roles of SB-269970 versus ketanserin on carbon tetrachloride-induced liver fibrosis in rats: Oxidative stress/TGF-β 1 -induced HSCs activation pathway. Pharmacological Reports, 70 (3), 509–518. https://doi.org/10.1016/j.pharep.2017.11.017
- Ford, A. C., Sperber, A. D., Corsetti, M., Camilleri, M. (2020). Irritable bowel syndrome. The Lancet, 396 (10263), 1675–1688. https://doi.org/10.1016/s0140-6736(20)31548-8
- Gros, M., Gros, B., Mesonero, J. E., Latorre, E. (2021). Neurotransmitter Dysfunction in Irritable Bowel Syndrome: Emerging Approaches for Management. Journal of Clinical Medicine, 10 (15), 3429. https://doi.org/10.3390/jcm10153429
- Kumar, A., Pramanik, J., Goyal, N., Chauhan, D., Sivamaruthi, B. S., Prajapati, B. G., Chaiyasut, C. (2023). Gut Microbiota in Anxiety and Depression: Unveiling the Relationships and Management Options. Pharmaceuticals, 16 (4), 565. https://doi.org/10.3390/ph16040565
- Nobis, A., Zalewski, D., Waszkiewicz, N. (2020). Peripheral Markers of Depression. Journal of Clinical Medicine, 9 (12), 3793. https://doi.org/10.3390/jcm9123793
- Beaglehole, B., Mulder, R. T., Frampton, C. M., Boden, J. M., Newton-Howes, G., Bell, C. J. (2018). Psychological distress and psychiatric disorder after natural disasters: systematic review and meta-analysis. The British Journal of Psychiatry, 213 (6), 716–722. https://doi.org/10.1192/bjp.2018.210
- Chaves, C., Castellanos, T., Abrams, M., Vazquez, C. (2018). The impact of economic recessions on depression and individual and social well-being: the case of Spain (2006–2013). Social Psychiatry and Psychiatric Epidemiology, 53 (9), 977–986. https://doi.org/10.1007/s00127-018-1558-2
- Bear, T. L. K., Dalziel, J. E., Coad, J., Roy, N. C., Butts, C. A., Gopal, P. K. (2020). The Role of the Gut Microbiota in Dietary Interventions for Depression and Anxiety. Advances in Nutrition, 11 (4), 890–907. https://doi.org/10.1093/advances/nmaa016
- Shabbir, M. A., Mehak, F., Khan, Z. M., Ahmed, W., Haq, S. M. A. U., Khan, M. R. et al. (2022). Delving the role of nutritional psychiatry to mitigate the COVID-19 pandemic induced stress, anxiety and depression. Trends in Food Science & Technology, 120, 25–35. https://doi.org/10.1016/j.tifs.2021.12.035
- Álvarez, S. A., Rocha-Guzmán, N. E., González-Laredo, R. F., Gallegos-Infante, J. A., Moreno-Jiménez, M. R., Bravo-Muñoz, M. (2022). Ancestral Food Sources Rich in Polyphenols, Their Metabolism, and the Potential Influence of Gut Microbiota in the Management of Depression and Anxiety. Journal of Agricultural and Food Chemistry, 70 (4), 944–956. https://doi.org/10.1021/acs.jafc.1c06151
- Zhang, B., Chen, T., Cao, M., Yuan, C., Reiter, R. J., Zhao, Z. et al. (2022). Gut Microbiota Dysbiosis Induced by Decreasing Endogenous Melatonin Mediates the Pathogenesis of Alzheimer’s Disease and Obesity. Frontiers in Immunology, 13. https://doi.org/10.3389/fimmu.2022.900132
- Rothschild, D., Weissbrod, O., Barkan, E., Kurilshikov, A., Korem, T., Zeevi, D. et al. (2018). Environment dominates over host genetics in shaping human gut microbiota. Nature, 555 (7695), 210–215. https://doi.org/10.1038/nature25973
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2025 Yelyzaveta Sirchak

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.
Автори, які публікуються у цьому журналі, погоджуються з наступними умовами:
1. Автори залишають за собою право на авторство своєї роботи та передають журналу право першої публікації цієї роботи на умовах ліцензії Creative Commons CC BY, котра дозволяє іншим особам вільно розповсюджувати опубліковану роботу з обов'язковим посиланням на авторів оригінальної роботи та першу публікацію роботи у цьому журналі.
2. Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження роботи у тому вигляді, в якому вона була опублікована цим журналом (наприклад, розміщувати роботу в електронному сховищі установи або публікувати у складі монографії), за умови збереження посилання на першу публікацію роботи у цьому журналі.









