Клініко-гематологічні та імунологічні аспекти хронічної мієлоїдної лейкемії: від молекулярних механізмів до функціонального одужання
DOI:
https://doi.org/10.15587/2519-4798.2025.340270Ключові слова:
хронічна мієлоїдна лейкемія, йкемічні стовбурові клітини CD26 , додаткові мутації ASXL1/RUNX1/TP53, позаклітинні везикули, фероптоз, природні кілери, PD-1, NKG2A-HLA-E, інгібітори тирозинкіназ, ремісія без лікуванняАнотація
Мета. Систематизувати й критично проаналізувати дані щодо клініко-гематологічних, молекулярних та імунологічних детермінант перебігу хронічної мієлоїдної лейкемії (ХМЛ) та досяжності ремісії без лікування (TFR), з акцентом на патофізіологічні механізми лейкемічних стовбурових клітин (ЛСК, CD26+), додаткових мутацій (ASXL1, RUNX1, TP53), позаклітинних везикул (EVs), фероптозу й осей імунного контролю (PD-1/PD-L1, NKG2A-HLA-E), а також імуномодулюючі ефекти інгібіторів тирозинкіназ (ІТК).
Матеріали та методи. Проведено цільовий наративний огляд керівництв (ELN, NCCN) і рецензованих публікацій за 2000–2025 рр. з PubMed/PMC та профільних журналів. Узагальнено клінічні предиктори відповіді, патофізіологічні механізми резистентності, імунні біомаркери успіху TFR; виконано концептуальний синтез доказів щодо впливу ІТК різних поколінь на імунний ландшафт, з урахуванням пост-COVID контексту.
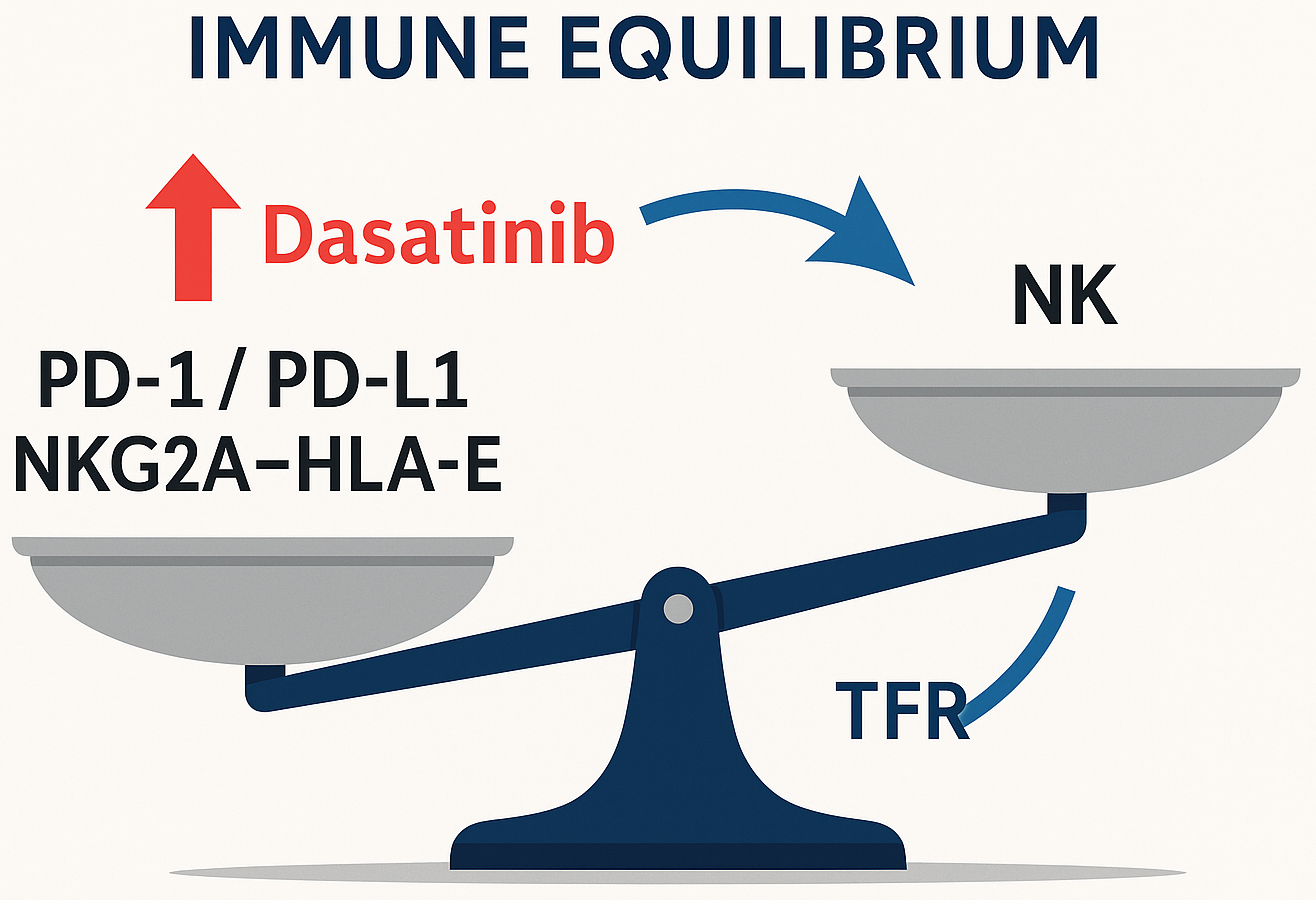
Результати. CD26+ ЛСК визначають ранню динаміку молекулярної відповіді на ІТК, але їхня персистенція під час TFR не є самодостатнім предиктором рецидиву, що підкреслює провідну роль імунного нагляду. Додаткові мутації ASXL1/RUNX1/TP53 асоціюються з гіршою подієвільною виживаністю і потребою ранньої інтенсифікації стратегії. EVs переносять онкогенні сигнали (зокрема транскрипт BCR-ABL1) і формують імуносупресивне мікрооточення. Резистентні до іматинібу клітинні моделі демонструють підвищену чутливість до індукторів фероптозу, що відкриває новий терапевтичний вектор. Успішна TFR пов’язана з вищою кількістю та зрілістю NK-клітин (CD56+ CD16+ CD57+), наявністю «memory-like» NK (NKG2C+), високим вмістом перфорину в NK та «вроджених» CD8+ Т-клітинах за одночасно низької експресії PD-1. Вісь NKG2A-HLA-E виступає додатковим «гальмом» цитотоксичності; її блокада потенційно синергує з анти-PD-1. Дазатиніб, на відміну від іматинібу/нілотинібу, частково знімає інгібування через NKG2A, підсилюючи NK-цитотоксичність. Пандемія COVID-19 змінила імунні «відбитки» пацієнтів (менша чисельність NK за вищої активації), що слід враховувати при відборі на TFR.
Висновки. Контроль ХМЛ – це баланс глибокої циторедукції ІТК і компетентного імунного нагляду. Персоналізована тактика має поєднувати: ранню ідентифікацію високоризикових мутацій, таргетинг CD26+ ЛСК, модифікацію EV-сигналінгу й індукцію фероптозу, а також імунотерапевтичні комбінації (блокада PD-1/PD-L1 та/або NKG2A-HLA-E), що здатні підвищити частку пацієнтів, придатних до стійкої TFR, і наблизити концепт функціонального одужання
Посилання
- Sicuranza, A., Cavalleri, A., Bernardi, S. (2025). The biology of chronic myeloid leukemia: an overview of the new insights and biomarkers. Frontiers in Oncology, 15. https://doi.org/10.3389/fonc.2025.1546813
- Hochhaus, A., Baccarani, M., Silver, R. T., Schiffer, C., Apperley, J. F., Cervantes, F. et al. (2020). European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia, 34 (4), 966–984. https://doi.org/10.1038/s41375-020-0776-2
- Shah, N. P., Bhatia, R., Altman, J. K., Amaya, M., Begna, K. H., Berman, E. et al. (2024). Chronic Myeloid Leukemia, Version 2.2024, NCCN Clinical Practice Guidelines in Oncology. Journal of the National Comprehensive Cancer Network, 22 (1), 43–69. https://doi.org/10.6004/jnccn.2024.0007
- Cross, N. C. P., Ernst, T., Branford, S., Cayuela, J.-M., Deininger, M., Fabarius, A. et al. (2023). European LeukemiaNet laboratory recommendations for the diagnosis and management of chronic myeloid leukemia. Leukemia, 37 (11), 2150–2167. https://doi.org/10.1038/s41375-023-02048-y
- Kwaśnik, P., Giannopoulos, K. (2021). Treatment-Free Remission – A New Aim in the Treatment of Chronic Myeloid Leukemia. Journal of Personalized Medicine, 11 (8), 697. https://doi.org/10.3390/jpm11080697
- Zhong, F., Zhang, X., Wang, Z., Li, X., Huang, B., Kong, G., Wang, X. (2024). The therapeutic and biomarker significance of ferroptosis in chronic myeloid leukemia. Frontiers in Immunology, 15. https://doi.org/10.3389/fimmu.2024.1402669
- Sanchez, M. B., Vasconcelos Cordoba, B., Pavlovsky, C., Moiraghi, B., Varela, A., Custidiano, R. et al. (2023). In-depth characterization of NK cell markers from CML patients who discontinued tyrosine kinase inhibitor therapy. Frontiers in Immunology, 14. https://doi.org/10.3389/fimmu.2023.1241600
- Garcia, C. A. B., Binelli, L. S., Palma, L. C., Marani, L. O., Medeiros, M., Carvalho, A. G. De et al. (2024). Immune Content of Mature and Licensed Cytotoxic Cells Is Associated with Treatment-Free Remission in Chronic Myeloid Leukemia. Blood, 144, 1756–1756. https://doi.org/10.1182/blood-2024-208109
- Decroos, A., Meddour, S., Demoy, M., Piccirilli, N., Rousselot, P., Nicolini, F. E. et al. (2024). The CML experience to elucidate the role of innate T-cells as effectors in the control of residual cancer cells and as potential targets for cancer therapy. Frontiers in Immunology, 15. https://doi.org/10.3389/fimmu.2024.1473139
- Li, Y., Li, Z., Tang, Y., Zhuang, X., Feng, W., Boor, P. P. C. et al. (2024). Unlocking the therapeutic potential of the NKG2A-HLA-E immune checkpoint pathway in T cells and NK cells for cancer immunotherapy. Journal for ImmunoTherapy of Cancer, 12 (10), e009934. https://doi.org/10.1136/jitc-2024-009934
- Radich, J. P., Wall, M., Branford, S., Campbell, C. D., Chaturvedi, S., DeAngelo, D. J. et al. (2023). Molecular response in newly diagnosed chronic-phase chronic myeloid leukemia: prediction modeling and pathway analysis. Haematologica, 108 (6), 1567–1578. https://doi.org/10.3324/haematol.2022.281878
- Sanchez, M. B., Cordoba, B. V., Pavlovsky, C., Moiraghi, B., Varela, A. I., Giere, I. et al. (2025). The Influence of the COVID-19 Pandemic in NK Cell Subpopulations from CML Patients Enrolled in the Argentina Stop Trial. Cells, 14 (9), 628. https://doi.org/10.3390/cells14090628
- Nasnas, P. E., Jabbour, E. J., Sasaki, K., Issa, G. C., Masarova, L., Short, N. J., Haddad, F. G. (2024). Failure of Treatment-Free Remission after a Prolonged Deep Molecular Response in Patients with Chronic Myeloid Leukemia. Acta Haematologica, 148 (1), 105–110. Portico. https://doi.org/10.1159/000538651
- Coyle, C., Ma, M., Abraham, Y., Mahony, C. B., Steel, K., Simpson, C. et al. (2024). NK cell subsets define sustained remission in rheumatoid arthritis. JCI Insight, 9 (23). https://doi.org/10.1172/jci.insight.182390
- Camacho, M. F., Peña, M., Toloza, M. J., Moiraghi, B., Enrico, A., Mariano, R. et al. (2025). Evaluation of leukemic stem cell (CD26 +) in chronic myeloid leukemia patients with different molecular responses and in treatment-free remission. Clinical and Experimental Medicine, 25 (1). https://doi.org/10.1007/s10238-025-01626-x
- Wood, E. K., Reid, B. M., Sheerar, D. S., Donzella, B., Gunnar, M. R., Coe, C. L. (2024). Lingering Effects of Early Institutional Rearing and Cytomegalovirus Infection on the Natural Killer Cell Repertoire of Adopted Adolescents. Biomolecules, 14 (4), 456. https://doi.org/10.3390/biom14040456
- Kuznetsova, V., Krishnan, V., Costa, A., Ren, X., Ricketts, T. D., Patel, S. B. et al. (2025). Chronic inflammation deters natural killer cell fitness and cytotoxicity in myeloid leukemia. Blood Advances, 9 (4), 759–773. https://doi.org/10.1182/bloodadvances.2024014592
- Zhang, L., Zhao, Y., Dong, Y., Jiang, X. (2025). NK cell-based immunotherapy strategies for myeloid leukemia. Frontiers in Immunology, 16. https://doi.org/10.3389/fimmu.2025.1621885
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2025 Olena Kucher

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.
Автори, які публікуються у цьому журналі, погоджуються з наступними умовами:
1. Автори залишають за собою право на авторство своєї роботи та передають журналу право першої публікації цієї роботи на умовах ліцензії Creative Commons CC BY, котра дозволяє іншим особам вільно розповсюджувати опубліковану роботу з обов'язковим посиланням на авторів оригінальної роботи та першу публікацію роботи у цьому журналі.
2. Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження роботи у тому вигляді, в якому вона була опублікована цим журналом (наприклад, розміщувати роботу в електронному сховищі установи або публікувати у складі монографії), за умови збереження посилання на першу публікацію роботи у цьому журналі.









