Визначення впливу температури, концентрації оксидів феруму та окисних умов варки скла на зміщення рівноваги оксидів феруму FЕ2O3↔FЕO
DOI:
https://doi.org/10.15587/2706-5448.2023.283267Ключові слова:
оксиди феруму, стан рівноваги, окисно-відновний потенціал, варіння скла, хімічний аналізАнотація
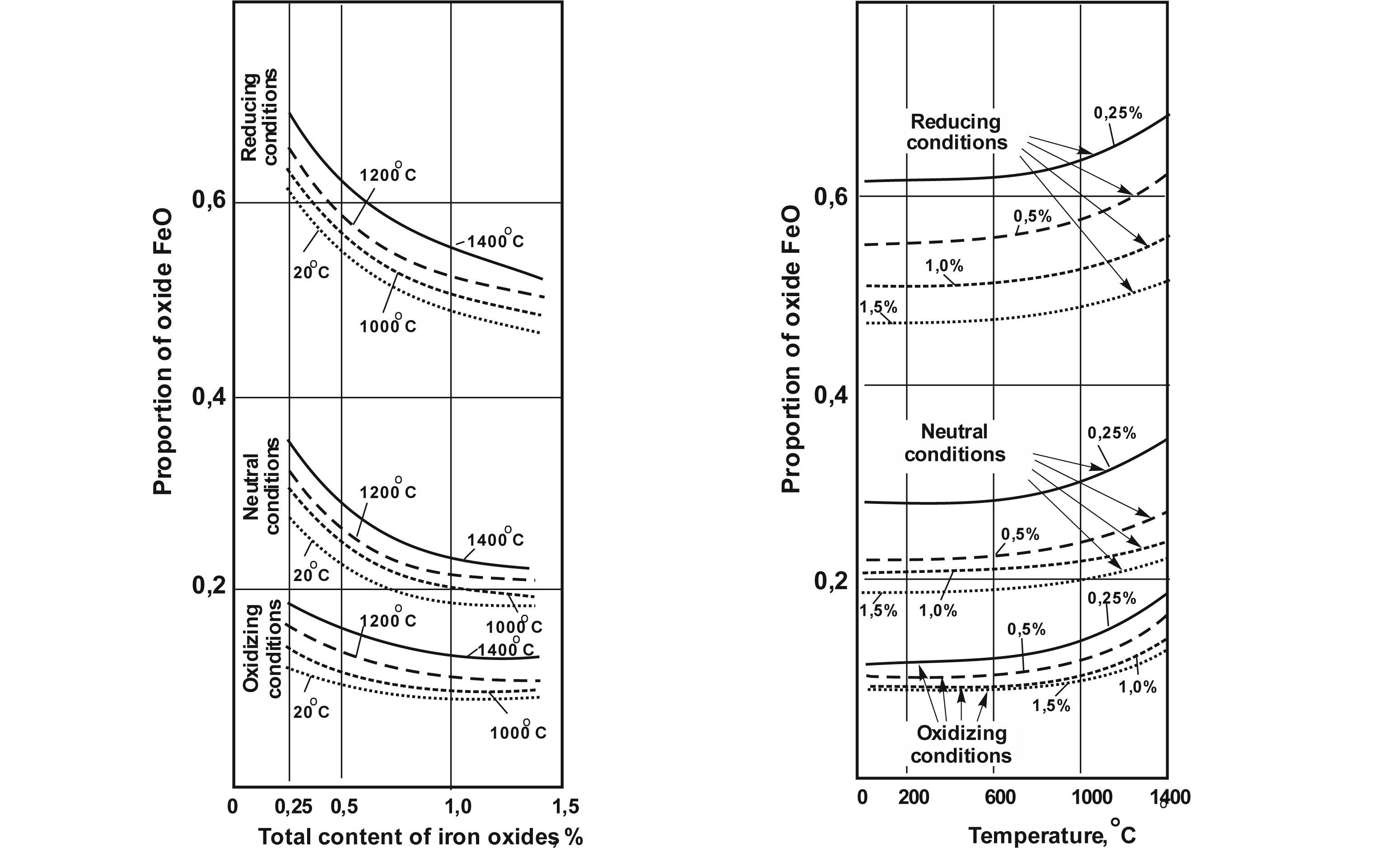
Об’єктом дослідження є стан рівноваги ферум(ІІ) та ферум(ІІІ) оксидів у розплавах скла при температурах 1000–1400 °С зварених в окисних, нейтральних та відновних умовах при вмісті оксидів феруму до 1,5 %.
Дана проблема актуальна в наступних аспектах.
Перший аспект даної проблеми – це небажана забарвленість скла: FeO забарвлює скло у синій колір, а Fe2O3 – у жовтий колір. Сумісна присутність ферум(ІІ) оксиду та ферум(ІІІ) оксиду обумовлює градації відтінків скла, що припадають на область зелених кольорів спектру.
Другий аспект стосується теплофізики процесів варіння стекол, що містять оксиди заліза. Ферум(ІІ) оксид обумовлює потужну смугу поглинання інфрачервоного випромінювання в області 1,1 мкм. Це стає на перешкоді об’ємному прогріванню скла в процесах варіння, формування, відпалу.
Третій аспект проблеми стосується питань будови стекол і склокристалічних матеріалів з підвищеним вмістом оксидів заліза. Оксиди заліза суттєво впливають на процеси структурування скла, так як ферум(ІІІ) оксид є типовим сіткоутворювачем, а ферум(ІІ) оксид – типовим модифікатором.
На стан рівноваги FeO↔Fe2O3 у склі суттєво впливають середовище варки скла, сумарна кількість оксидів заліза та температура розплаву. Найбільший вплив на рівновагу оксидів феруму у склі має середовище варіння скла. Частка оксиду FeO у сумарній кількості оксидів феруму (FeO+Fe2O3) різко зростає при переході від окиснювального середовища до нейтрального та далі – до відновного. При термостатуванні при температурі 1400 °С частка FeO у склі зростає при варінні в окисному середовищі у 1,4–1,7 разів, у нейтральному у 1,2–1,3 разів, а у відновному – приблизно у 1,1 рази. При цьому це зростання більш помітне у стеклах з меншим вмістом заліза.
Таким чином, стан рівноваги FeO↔Fe2O3 у склі суттєво впливає на технологічні та експлуатаційні властивості силікатних розплавів та кінцевого скла. Співвідношення утворених оксидів тривалентного та двовалентного феруму досліджували хімічним (титрометричним) аналізом.
Результати роботи можуть бути використані на практиці для розробки складу стекол з підвищеним вмістом оксидів феруму.
Посилання
- Plemyannikov, M., Zhdaniuk, N. (2020). Study of the possibility of recycling waste of metallurgical products for receipt of glass crystal. Norwegian Journal of Development of the International Science, 42-1, 51–58.
- Vercamer, V. (2016). Spectroscopic and Structural Properties of Iron in Silicate Glasses. Paris, 251.
- Falkovskaia, T. I. (1989). Pogloshchatelnaia sposobnost stekol, soderzhashchikh oksidy elementov perekhodnoi valentnosti v oblasti temperatur 290–1400. Kyiv.
- Calas, G., Petiau, J. (1983). Coordination of iron in oxide glasses through high-resolution K-edge spectra: Information from the pre-edge. Solid State Communications, 48 (7), 625–629. doi: https://doi.org/10.1016/0038-1098(83)90530-6
- Tasheva, T., Harizanova, R., Mihailova, I., Cherkezova‐Zheleva, Z., Paneva, D., Nedkova, M., Rüssel, C. (2023). Structure and redox ratio of soda‐lime‐silica glasses with high iron oxide concentrations. International Journal of Applied Glass Science, 14 (3), 445–454. doi: https://doi.org/10.1111/ijag.16626
- Alderman, O. L. G., Lazareva, L., Wilding, M. C., Benmore, C. J., Heald, S. M., Johnson, C. E. et al. (2017). Local structural variation with oxygen fugacity in Fe2SiO4+fayalitic iron silicate melts. Geochimica et Cosmochimica Acta, 203, 15–36. doi: https://doi.org/10.1016/j.gca.2016.12.038
- Peys, A., White, C. E., Olds, D., Rahier, H., Blanpain, B., Pontikes, Y. (2018). Molecular structure of CaO–FeOx–SiO2 glassy slags and resultant inorganic polymer binders. Journal of the American Ceramic Society, 101 (12), 5846–5857. doi: https://doi.org/10.1111/jace.15880
- Wisniewski, W., Harizanova, R., Völksch, G., Rüssel, C. (2011). Crystallisation of iron containing glass–ceramics and the transformation of hematite to magnetite. CrystEngComm, 13 (12), 4025–4031. doi: https://doi.org/10.1039/c0ce00629g
- Chevrel, M. O., Giordano, D., Potuzak, M., Courtial, P., Dingwell, D. B. (2013). Physical properties of CaAl2Si2O8–CaMgSi2O6–FeO–Fe2O3 melts: Analogues for extra-terrestrial basalt. Chemical Geology, 346, 93–105. doi: https://doi.org/10.1016/j.chemgeo.2012.09.004
- Plemiannikov, M. M., Zhdaniuk, N. V. (2021). Ferrosilicate glass ceramics based on wastes from ore concentration. Voprosy Khimii i Khimicheskoi Tekhnologii, 2, 95–103. doi: https://doi.org/10.32434/0321-4095-2021-135-2-95-103
- Kress, V. C., Carmichael, I. S. E. (1991). The compressibility of silicate liquids containing Fe2O3 and the effect of composition, temperature, oxygen fugacity and pressure on their redox states. Contributions to Mineralogy and Petrology, 108 (1-2), 82–92. doi: https://doi.org/10.1007/bf00307328
- Di Genova, D., Hess, K.-U., Chevrel, M. O., Dingwell, D. B. (2016). Models for the estimation of Fe3+/Fetotratio in terrestrial and extraterrestrial alkali- and iron-rich silicate glasses using Raman spectroscopyk. American Mineralogist, 101 (4), 943–952. doi: https://doi.org/10.2138/am-2016-5534ccbyncnd
- Plemiannikov, M. M., Krupa, A. A. (2000). Khimiia ta teplofizyka skla. Kyiv: NTUU «KPI», 560.
- Hughes, E. C., Buse, B., Kearns, S. L., Brooker, R. A., Di Genova, D., Kilgour, G., Mader, H. M., Blundy, J. D. (2020). The microanalysis of iron and sulphur oxidation states in silicate glass – Understanding the effects of beam damage. IOP Conference Series: Materials Science and Engineering, 891 (1), 012014. doi: https://doi.org/10.1088/1757-899x/891/1/012014
- Mysen, B., Virgo, D., Sieferd, F. (1984). Redox equilibria of iron in alkaline earth silicate melts: relationships between melt structure, oxygen fugacity, temperature and properties of iron-bearing silicate liquids. American Mineralogist, 69, 834–847.
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2023 Mykola Plemyannikov, Nataliіa Zhdanіuk

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Закріплення та умови передачі авторських прав (ідентифікація авторства) здійснюється у Ліцензійному договорі. Зокрема, автори залишають за собою право на авторство свого рукопису та передають журналу право першої публікації цієї роботи на умовах ліцензії Creative Commons CC BY. При цьому вони мають право укладати самостійно додаткові угоди, що стосуються неексклюзивного поширення роботи у тому вигляді, в якому вона була опублікована цим журналом, але за умови збереження посилання на першу публікацію статті в цьому журналі.








