Модуляція властивостей мезенхімальних стромальних клітин мікрооточенням у 3D культурі
DOI:
https://doi.org/10.15587/2519-8025.2023.288082Ключові слова:
мезенхімальні стромальні клітини, тривимірне культивування, гідрогель з плазми крові, альгінатні мікросфери, макропористі скафолдиАнотація
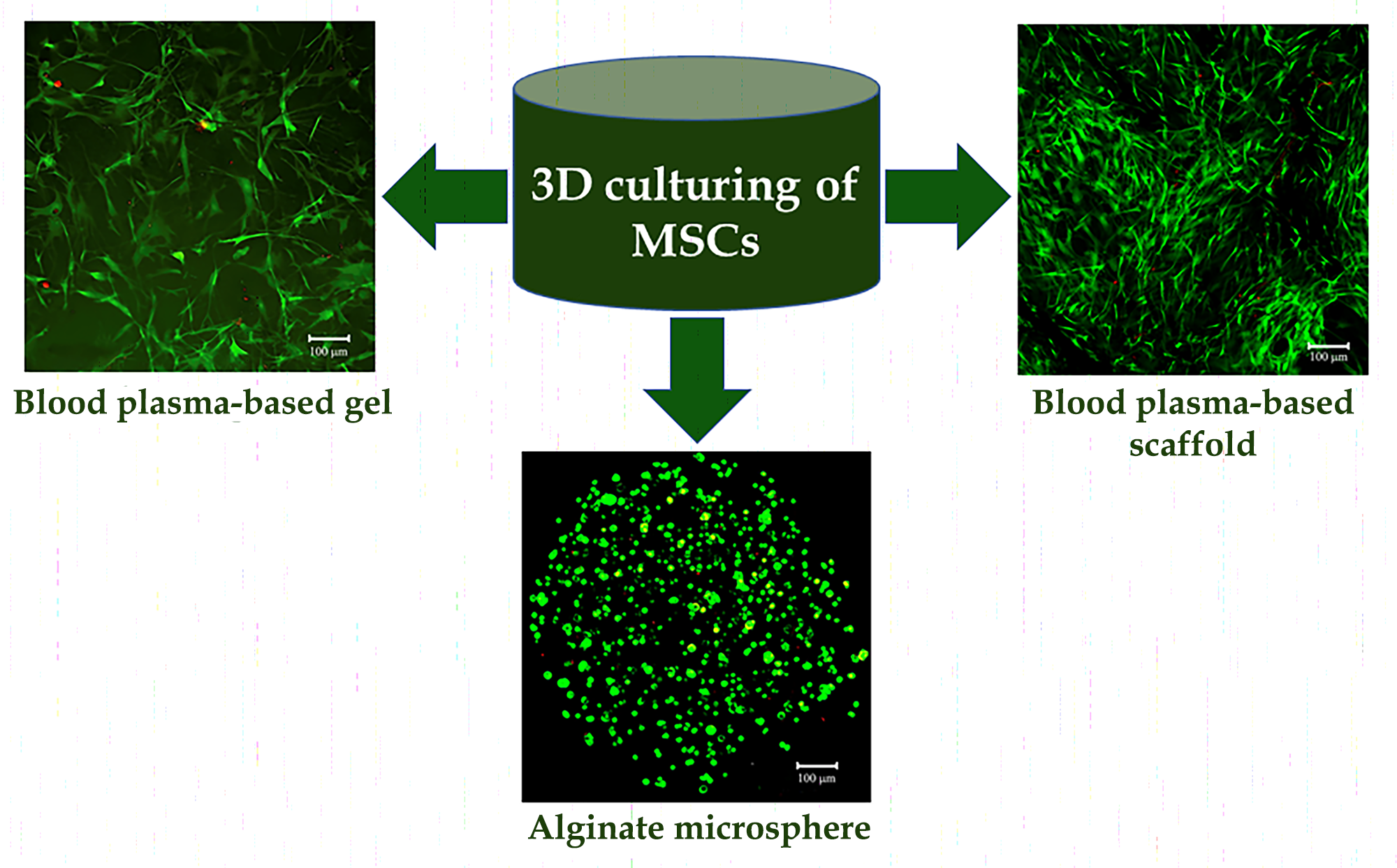
Мета – порівняння форми, життєздатності, метаболічної та проліферативної активності мезенхімальних стромальних клітин (МСК) за культивування у складі гідрогелів та макропористих скафолдів.
Матеріали та методи. МСК жирової тканини людини виділяли з ліпоаспіратів дорослих здорових донорів після отримання інформованої згоди. Гідрогелі отримували зі збідненої на тромбоцити плазми крові людини та полімеру альгінату, зшитого іонами кальцію у мікросфери. Макропористі скафолди створювали з плазми методом кріотропного гелеутворення. Морфологію та життєздатність клітин у складі носіїв оцінювали, використовуючи вітальні барвники. Метаболічну та проліферативну активність МСК вивчали за допомогою Alamar Blue тесту на 1, 3 і 7-му добу 3D культивування.
Результати. Тривимірні скафолди з плазми крові мали розгалужену структуру пор з розміром, достатнім для проліферації та міграції клітин. Коли білки плазми зшивали L-цистеїном, майже всі МСК були життєздатні, прикріплювались до поверхні пор, розпластувались та проліферували, заповнюючи порожнечі носія. У гідрогелях з плазми МСК заповнювали носій та набували фібробластоподібну морфологію, зберігаючи життєздатність. У альгінатних мікросферах МСК були рівномірно розподілені по всьому об’єму гелю, зберігали сферичну форму, але високу життєздатність. Найвища метаболічна активність МСК спостерігалась у макропористих скафолдах, найнижча – в альгінатних мікросферах. За культивування активність клітин у макропористих скафолдах та гідрогелях з плазми суттєво зростала, що опосередковано свідчило про процеси проліферації.
Висновки. За 3D культивування властивості МСК суттєво залежать від мікрооточення: у складі носіїв, створених з плазми крові, клітини набувають фібробластоподібну морфологію та проліферують, а в альгінатних мікросфери залишаються сферичними та не проліферують
Спонсор дослідження
- National Research Foundation of Ukraine (project No. 2021.01/0276)
Посилання
- Renesme, L., Pierro, M., Cobey, K. D., Mital, R., Nangle, K., Shorr, R., Lalu, M. M., Thébaud, B. (2022). Definition and Characteristics of Mesenchymal Stromal Cells in Preclinical and Clinical Studies: A Scoping Review. Stem Cells Translational Medicine, 11 (1), 44–54. doi: https://doi.org/10.1093/stcltm/szab009
- Langer, R., Vacanti, J. P. (1993). Tissue Engineering. Science, 260 (5110), 920–926. doi: https://doi.org/10.1126/science.8493529
- Rech, J., Getinger-Panek, A., Gałka, S., Bednarek, I. (2022). Origin and Composition of Exosomes as Crucial Factors in Designing Drug Delivery Systems. Applied Sciences, 12 (23), 12259. doi: https://doi.org/10.3390/app122312259
- Jensen, C., Teng, Y. (2020). Is It Time to Start Transitioning From 2D to 3D Cell Culture? Frontiers in Molecular Biosciences, 7. doi: https://doi.org/10.3389/fmolb.2020.00033
- Tan, L., Liu, X., Dou, H., Hou, Y. (2022). Characteristics and regulation of mesenchymal stem cell plasticity by the microenvironment – specific factors involved in the regulation of MSC plasticity. Genes & Diseases, 9 (2), 296–309. doi: https://doi.org/10.1016/j.gendis.2020.10.006
- Dhamecha, D., Movsas, R., Sano, U., Menon, J. U. (2019). Applications of alginate microspheres in therapeutics delivery and cell culture: Past, present and future. International Journal of Pharmaceutics, 569, 118627. doi: https://doi.org/10.1016/j.ijpharm.2019.118627
- Pravdyuk, A. I., Petrenko, Y. A., Fuller, B. J., Petrenko, A. Y. (2013). Cryopreservation of alginate encapsulated mesenchymal stromal cells. Cryobiology, 66 (3), 215–222. doi: https://doi.org/10.1016/j.cryobiol.2013.02.002
- Tarusin, D., Mazur, S., Volkova, N., Petrenko, Yu., Zaikov, V., Petrenko, A. (2016). Encapsulation of mesenchymal stromal cells in alginate microspheres. Biotechnologia Acta, 9 (4), 58–66. doi: https://doi.org/10.15407/biotech9.04.058
- Petrenko, Yu. A., Ivanov, R. V., Petrenko, A. Yu., Lozinsky, V. I. (2011). Coupling of gelatin to inner surfaces of pore walls in spongy alginate-based scaffolds facilitates the adhesion, growth and differentiation of human bone marrow mesenchymal stromal cells. Journal of Materials Science: Materials in Medicine, 22 (6), 1529–1540. doi: https://doi.org/10.1007/s10856-011-4323-6
- Elowsson, L., Kirsebom, H., Carmignac, V., Mattiasson, B., Durbeej, M. (2013). Evaluation of macroporous blood and plasma scaffolds for skeletal muscle tissue engineering. Biomaterials Science, 1 (4), 402–410. doi: https://doi.org/10.1039/c2bm00054g
- Rogulska, O., Petrenko, Y., Petrenko, A. (2016). DMSO-free cryopreservation of adipose-derived mesenchymal stromal cells: expansion medium affects post-thaw survival. Cytotechnology, 69 (2), 265–276. doi: https://doi.org/10.1007/s10616-016-0055-2
- Zuk, P. A., Zhu, M., Ashjian, P., De Ugarte, D. A., Huang, J. I., Mizuno, H. et al. (2002). Human Adipose Tissue Is a Source of Multipotent Stem Cells. Molecular Biology of the Cell, 13 (12), 4279–4295. doi: https://doi.org/10.1091/mbc.e02-02-0105
- Rogulska, O. Y., Trufanova, N. A., Petrenko, Y. A., Repin, N. V., Grischuk, V. P., Ashukina, N. O. et al. (2021). Generation of bone grafts using cryopreserved mesenchymal stromal cells and macroporous collagen‐nanohydroxyapatite cryogels. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 110 (2), 489–499. doi: https://doi.org/10.1002/jbm.b.34927
- Dhurat, R., Sukesh, M. (2014). Principles and methods of preparation of platelet-rich plasma: A review and author′s perspective. Journal of Cutaneous and Aesthetic Surgery, 7 (4), 189–197. doi: https://doi.org/10.4103/0974-2077.150734
- Lozinsky, V. I., Galaev, I. Yu., Plieva, F. M., Savina, I. N., Jungvid, H., Mattiasson, B. (2003). Polymeric cryogels as promising materials of biotechnological interest. Trends in Biotechnology, 21 (10), 445–451. doi: https://doi.org/10.1016/j.tibtech.2003.08.002
- Dankberg, F., Persidsky, M. D. (1976). A test of granulocyte membrane integrity and phagocytic function. Cryobiology, 13 (4), 430–432. doi: https://doi.org/10.1016/0011-2240(76)90098-5
- Petrenko, Yu. A., Gorokhova, N. A., Tkachova, E. N., Petrenko, A. Yu. (2005). The reduction of Alamar Blue by peripheral blood lymphocytes and isolated mitochondria. The Ukrainian Biochemical Journal, 77 (5), 100–105.
- Discher, D. E., Mooney, D. J., Zandstra, P. W. (2009). Growth Factors, Matrices, and Forces Combine and Control Stem Cells. Science, 324 (5935), 1673–1677. doi: https://doi.org/10.1126/science.1171643
- de Vos, P., Faas, M. M., Strand, B., Calafiore, R. (2006). Alginate-based microcapsules for immunoisolation of pancreatic islets. Biomaterials, 27 (32), 5603–5617. doi: https://doi.org/10.1016/j.biomaterials.2006.07.010
- Kumar, V. B., Tiwari, O. S., Finkelstein-Zuta, G., Rencus-Lazar, S., Gazit, E. (2023). Design of Functional RGD Peptide-Based Biomaterials for Tissue Engineering. Pharmaceutics, 15 (2), 345. doi: https://doi.org/10.3390/pharmaceutics15020345
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2023 Oleksandr Petrenko, Olena Rogulska, Natalia Trufanova, Oleh Trufanov, Oleksandra Hubenia, Olena Revenko, Daria Cherkashina

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.
Автори, які публікуються у цьому журналі, погоджуються з наступними умовами:
1. Автори залишають за собою право на авторство своєї роботи та передають журналу право першої публікації цієї роботи на умовах ліцензії Creative Commons CC BY, котра дозволяє іншим особам вільно розповсюджувати опубліковану роботу з обов'язковим посиланням на авторів оригінальної роботи та першу публікацію роботи у цьому журналі.
2. Автори мають право укладати самостійні додаткові угоди щодо неексклюзивного розповсюдження роботи у тому вигляді, в якому вона була опублікована цим журналом (наприклад, розміщувати роботу в електронному сховищі установи або публікувати у складі монографії), за умови збереження посилання на першу публікацію роботи у цьому журналі.








