Study of the antiulcer properties of extracts obtained from the fruit of the domestic plum (Prunus Domestica L.)
DOI:
https://doi.org/10.15587/2519-8025.2025.342552Keywords:
anti-ulcer activity, antioxidant properties, peptic ulcer disease, phytopharmaceuticals, Prunus domesticaAbstract
Aim. To search for and select an effective dose of plant extracts with anti-ulcer activity, obtained from the fruits of Prunus domestica L. (family Rosaceae, cultivar "Ugorka"), which are widely cultivated in Ukraine as a fruit-berry crop.
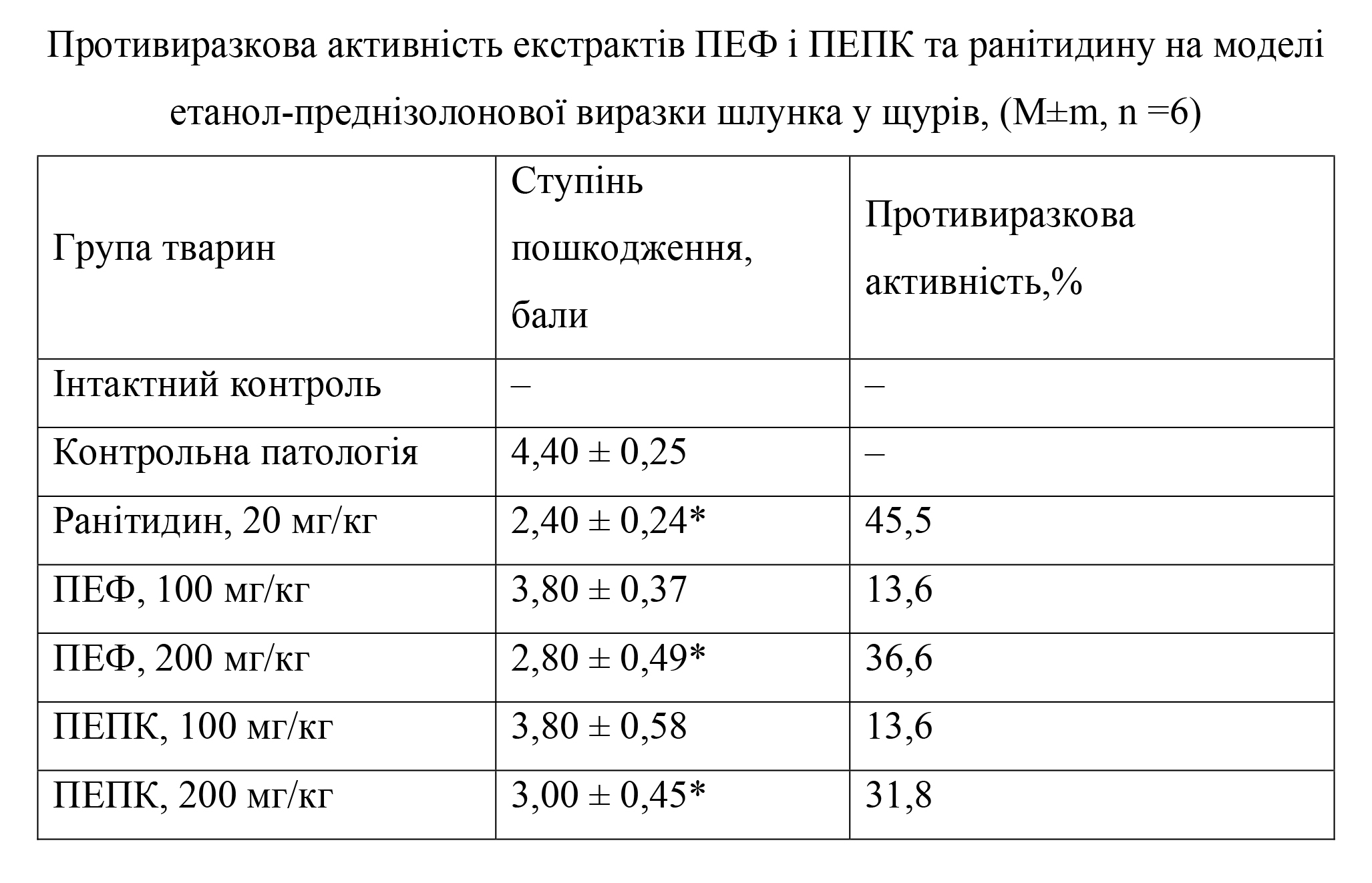
Materials and Methods. For the experimental investigation of the anti-ulcer activity of the extracts under study and the comparative drug ranitidine, two models were chosen, in which ulcers were induced on the gastric mucosa by an ethanol-prednisolone mixture and by indometacin solution. Against the background of the model pathology, biomarkers were measured in gastric homogenate and in blood serum: lipid peroxidation (LPO), thiobarbituric acid reactive substances (TBARS), diene conjugates (DC), and reduced glutathione (GSH). The degree of ulcer defect was assessed visually using a 5-point scale.
Results. Under the ethanol-prednisolone ulcer model in rats, after administration of the extract PEF at a dose of 200 mg/kg, a reduction in the degree of ulcer defect by 36.6 % was observed; inhibition of the LPO process was accompanied by a decrease in serum DC by 1.4-fold, TBARS by 1.8-fold, and an increase in GSH by 1.2-fold. In the gastric homogenate, a significant increase in GSH by 1.4-fold and a decrease in DC and TBARS by 1.4-fold were also observed. The extract PEPC at 200 mg/kg was also effective in this ulcer model, with anti-ulcer activity of 31.8 %, confirmed by normalization of biochemical parameters in serum and gastric homogenate.
A marked anti-ulcer effect was also observed in the indometacin ulcer model and was confirmed by a significant reduction in ulcer formation by 1.4-fold and 1.5-fold, respectively, when treated with PEF extract at doses of 100 and 200 mg/kg compared to animals in the control group. A statistically significant enhancement of antioxidant defense in gastric homogenate (1.2-fold) and liver homogenate (1.3-fold) was noted at 100 mg/kg, and 1.4-fold at 200 mg/kg.
The administration of PEPC extract at doses of 100 and 200 mg/kg in the indometacin ulcer model positively affected the general condition of the animals and reduced the degree of damage to the gastric mucosa (GSM). There was inhibition of LPO processes, evidenced by statistically significant decreases in TBARS in gastric homogenate (1.3-fold and 1.5-fold, respectively) and liver (1.4-fold). A significant increase in antioxidant defense was also detected in gastric homogenate (1.3-fold) and liver homogenate (1.4-fold) at 100 mg/kg and 1.5-fold at 200 mg/kg.
Conclusions. In the conditions of experimental gastric ulcers in animals, treated with the PEF and PEPC extracts, moderate anti-ulcer properties were observed, although they were inferior to the comparative drug ranitidine. It has been demonstrated that the PEF and PEPC extracts inhibit the course of LPO reactions and support endogenous antioxidant defense systems
References
- Rahman, M., Islam, F., Parvez, A., Azad, A. K., Ashraf, G. M., Ullah, M. F., Ahmed, M. (2022). Citrus limon L. (lemon) seed extract shows neuro-modulatory activity in an in vivo thiopental-sodium sleep model by reducing the sleep onset and enhancing the sleep duration. Journal of Integrative Neuroscience, 21(1). https://doi.org/10.31083/j.jin2101042
- Rahman, M., Islam, R., Shohag, S., Hossain, E., Rahaman, S., Islam, F. et al. (2022). The Multifunctional Role of Herbal Products in the Management of Diabetes and Obesity: A Comprehensive Review. Molecules, 27 (5), 1713. https://doi.org/10.3390/molecules27051713
- Tagde, P., Tagde, P., Islam, F., Tagde, S., Shah, M., Hussain, Z. D. et al. (2021). The Multifaceted Role of Curcumin in Advanced Nanocurcumin Form in the Treatment and Management of Chronic Disorders. Molecules, 26 (23), 7109. https://doi.org/10.3390/molecules26237109
- Akter, A., Islam, F., Bepary, S., Al-Amin, Md., Begh, Z. A., Islam, A. F. U. et al. (2022). CNS depressant activities of Averrhoa carambola leaves extract in thiopental-sodium model of Swiss albino mice: implication for neuro-modulatory properties. Biologia, 77 (5), 1337–1346. https://doi.org/10.1007/s11756-022-01057-z
- Tallei, T. E., Fatimawali, Niode, N. J., Idroes, R., Zidan, B. M. R. M., Mitra, S. et al. (2021). A Comprehensive Review of the Potential Use of Green Tea Polyphenols in the Management of COVID-19. Evidence-Based Complementary and Alternative Medicine, 2021, 1–13. https://doi.org/10.1155/2021/7170736
- Fernández, J., Silván, B., Entrialgo-Cadierno, R., Villar, C. J., Capasso, R., Uranga, J. A. et al. (2021). Antiproliferative and palliative activity of flavonoids in colorectal cancer. Biomedicine & Pharmacotherapy, 143, 112241. https://doi.org/10.1016/j.biopha.2021.112241
- Sathyanarayanan, S., Chandran, R., Rajan, M., Thangaraj, P.; Thangaraj, P. (Ed.) (2018). Pharmacognostical and Phytochemical Investigation on Pterolobium hexapetalum (Roth.) Sant. & Wagh. Medicinal Plants. New York: CRC Press, 269–284. https://doi.org/10.1201/9781351046510-14
- Ahmed, S., Khan, H., Aschner, M., Mirzae, H., Küpeli Akkol, E., Capasso, R. (2020). Anticancer Potential of Furanocoumarins: Mechanistic and Therapeutic Aspects. International Journal of Molecular Sciences, 21 (16), 5622. https://doi.org/10.3390/ijms21165622
- Küpeli Akkol, E., Genç, Y., Karpuz, B., Sobarzo-Sánchez, E., Capasso, R. (2020). Coumarins and Coumarin-Related Compounds in Pharmacotherapy of Cancer. Cancers, 12 (7), 1959–2025. https://doi.org/10.3390/cancers12071959
- Aliakbarzadeh, G., Sereshti, H., Parastar, H. (2016). Pattern recognition analysis of chromatographic fingerprints of Crocus sativus L. secondary metabolites towards source identification and quality control. Analytical and Bioanalytical Chemistry, 408 (12), 3295–3307. https://doi.org/10.1007/s00216-016-9400-8.
- The Selection and Use of Essential Medicines (2015). WHO Technical Report Series, No. 994. World Health Organization, 568. Available at: https://www.who.int/publications/i/item/9789241209946
- Awodele, O., Popoola, T. D., Amadi, K. C., Coker, H. A. B., Akintonwa, A. (2013). Traditional medicinal plants in Nigeria – Remedies or risks. Journal of Ethnopharmacology, 150 (2), 614–618. https://doi.org/10.1016/j.jep.2013.09.015
- Akindele, A. J., Adeneye, A. A., Salau, O. S., Sofidiya, M. O., Benebo, A. S. (2014). Dose and time-dependent sub-chronic toxicity study of hydroethanolic leaf extract of Flabellaria paniculata Cav. (Malpighiaceae) in rodents. Frontiers in Pharmacology, 5. https://doi.org/10.3389/fphar.2014.00078
- Kale, O. E., Awodele, O. (2016). Safety evaluation of Bon-santé cleanser® polyherbal in male Wistar rats. BMC Complementary and Alternative Medicine, 16 (1). https://doi.org/10.1186/s12906-016-1188-8
- Sathyanarayanan, S., Muniyandi, K., George, E., Sivaraj, D., Sasidharan, S. P., Thangaraj, P. (2017). Chemical profiling of Pterolobium hexapetalum leaves by HPLC analysis and its productive wound healing activities in rats. Biomedicine & Pharmacotherapy, 95, 287–297. https://doi.org/10.1016/j.biopha.2017.08.062
- da Silva Moreira, S., Tamashiro, L. K., Jorge, B. C., da Silva Balin, P., Heredia-Vieira, S. C., de Almeida, G. L. et al. (2019). Toxicological safety evaluation in acute and 28-day studies of aqueous extract from Serjania marginata Casar. (Sapindaceae) leaves in rats. Journal of Ethnopharmacology, 231, 197–204. https://doi.org/10.1016/j.jep.2018.11.024
- Sreeja, P. S., Arunachalam, K., Saikumar, S., Kasipandi, M., Dhivya, S., Murugan, R., Parimelazhagan, T. (2018). Gastroprotective effect and mode of action of methanol extract of Sphenodesme involucrata var. paniculata (C.B. Clarke) Munir (Lamiaceae) leaves on experimental gastric ulcer models. Biomedicine & Pharmacotherapy, 97, 1109–1118. https://doi.org/10.1016/j.biopha.2017.11.030
- Wang, Y., Su, W., Zhang, C., Xue, C., Chang, Y., Wu, X. et al. (2012). Protective effect of sea cucumber (Acaudina molpadioides) fucoidan against ethanol-induced gastric damage. Food Chemistry, 133 (4), 1414–1419. https://doi.org/10.1016/j.foodchem.2012.02.028
- Wang, Y., Wang, S. Lou, Zhang, J. Yi, Song, X. Ning, Zhang, Z. Yong, Li, J. Feng, Li, S. (2018). Anti-ulcer and anti-Helicobacter pylori potentials of the ethyl acetate fraction of Physalis alkekengi L. var. franchetii (Solanaceae) in rodent. Journal of Ethnopharmacology, 211, 197–206. https://doi.org/10.1016/j.jep.2017.09.004
- Pagano, E., Capasso, R., Piscitelli, F., Romano, B., Parisi, O. A., Finizio, S. et al. (2016). An Orally Active Cannabis Extract with High Content in Cannabidiol attenuates Chemically-induced Intestinal Inflammation and Hypermotility in the Mouse. Frontiers in Pharmacology, 7. https://doi.org/10.3389/fphar.2016.00341
- Martínez, V., Iriondo De-Hond, A., Borrelli, F., Capasso, R., del Castillo, M. D., Abalo, R. (2020). Cannabidiol and Other Non-Psychoactive Cannabinoids for Prevention and Treatment of Gastrointestinal Disorders: Useful Nutraceuticals? International Journal of Molecular Sciences, 21(9), 3067. https://doi.org/10.3390/ijms21093067
- Capasso, R., Orlando, P., Pagano, E., Aveta, T., Buono, L., Borrelli, F. et al. (2014). Palmitoylethanolamide normalizes intestinal motility in a model of post‐inflammatory accelerated transit: involvement of CB 1 receptors and TRPV 1 channels. British Journal of Pharmacology, 171 (17), 4026–4037. https://doi.org/10.1111/bph.12759
- Borrelli, F., Romano, B., Petrosino, S., Pagano, E., Capasso, R., Coppola, D. et al. (2014). Palmitoylethanolamide, a naturally occurring lipid, is an orally effective intestinal anti‐inflammatory agent. British Journal of Pharmacology, 172 (1), 142–158. https://doi.org/10.1111/bph.12907
- Pagano, E., Romano, B., Iannotti, F. A., Parisi, O. A., D’Armiento, M., Pignatiello, S. et al. (2019). The non-euphoric phytocannabinoid cannabidivarin counteracts intestinal inflammation in mice and cytokine expression in biopsies from UC pediatric patients. Pharmacological Research, 149, 104464. https://doi.org/10.1016/j.phrs.2019.104464
- Jabeen, Q., Aslam, N. (2011). The pharmacological activities of prunes: The dried plums. Journal of Medicinal Plants Research, 5 (9), 1508–1511.
- Ahmed, T., Sadia, H., Khalid, A., Batool, S., Janjua, A. (2010). Report: prunes and liver function: a clinical trial. Pakistan Journal of Pharmaceutical Sciences, 23 (4), 463–466. Available at: https://pubmed.ncbi.nlm.nih.gov/20884464/
- Ullah M., Ahmad A. (2019). Nutraceuticals and Natural Product Derivatives: Disease Prevention & Drug Discovery. Hoboken: Wiley-Blackwell, 414. Available at: https://www.researchgate.net/publication/348264386_Nutraceuticals_and_Natural_Product_Derivatives
- Bose, M., Kamra, M., Mullick, R., Bhattacharya, S., Das, S., Karande, A. A. (2017). Identification of a flavonoid isolated from plum (Prunus domestica) as a potent inhibitor of Hepatitis C virus entry. Scientific Reports, 7 (1). https://doi.org/10.1038/s41598-017-04358-5
- Igwe, E. O., Charlton, K. E. (2016). A Systematic Review on the Health Effects of Plums (Prunus domestica and Prunus salicina). Phytotherapy Research, 30 (5), 701–731. https://doi.org/10.1002/ptr.5581
- Jabbar Ali Al-Sahlanee, B., Koshova, O. Yu., Senyuk, I. V. (2019). The influence of extracts from prunus domestica on disorders of intestinal peristalsis induced by barium chloride action in mice. Pharmaceutical Review, 4, 66–72. https://doi.org/10.11603/2312-0967.2019.4.10669
- Senyuk, I. V., Jabbar Ali Al-Sahlanee, B., Shovkova, O. V. (2019). Pathophysiological association of a functional constipation and metabolic disorders. Perspectives on the pharmacocorrection of digestive system disorders by plant fibers as an example of the use of European plum (Prunus domestica). Health of Society, 8 (4), 124–132. https://doi.org/10.22141/2306-2436.8.4.2019.192178
- Ali Al-Sahlanee, B. J., Litkin, D. V., Senyuk, I. V. (2019). The study of the pharmacological action of the dry extract from Prunus domestica fruits on the model of comorbid functional constipation in the combined alcoholic liver damage in rats. Clinical Pharmacy, 23 (2), 6–14. https://doi.org/10.24959/167342
- Komisarenko A. M., Upyr T. V., Seniuk I. V., Bashar Al Dzhabar Ali, Sakhlani, Mokhammed Shakhm Basim, Lenchyk, L. V. (2017). Pat. No. 118457 UA. Sposib oderzhannia zasobu z poslabliuiuchoiu aktyvnistiu z plodiv slyvy domashnoi. MPK A61K36/736, B01D53/18, A61P1/10, A61K131/00. No. u201701747; declareted: 23.02.2017; published: 10.08.17, Bul. No. 15, 4.
- Minaiyan, M., Abolhasani, S., Sima, S., Yegdaneh, A. (2024). Effect of Tamarindus indica L. fruit pulp and seed extracts on experimental ulcerative colitis in rats. Research in Pharmaceutical Sciences, 19 (3), 276–286. https://doi.org/10.4103/rps.rps_131_23
- Stefanov, A. V. (2001). Doklinichni doslidzhennia likarskykh zasobiv. Kyiv: Avitsenna, 528. Available at: https://pubmed.com.ua/xmlui/handle/123456789/77
- Hladkykh, F. V. (2021). The effect of meloxicam and cryopreserved placenta extract on initial inflammatory response – an experimental study. Česká a Slovenská Farmacie, 70 (5), 179–185. https://doi.org/10.5817/csf2021-5-179
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2025 Liubov Galuzinska, Igor Seniuk, Vira Kravchenko, Olga Naboka

This work is licensed under a Creative Commons Attribution 4.0 International License.
Our journal abides by the Creative Commons CC BY copyright rights and permissions for open access journals.
Authors, who are published in this journal, agree to the following conditions:
1. The authors reserve the right to authorship of the work and pass the first publication right of this work to the journal under the terms of a Creative Commons CC BY, which allows others to freely distribute the published research with the obligatory reference to the authors of the original work and the first publication of the work in this journal.
2. The authors have the right to conclude separate supplement agreements that relate to non-exclusive work distribution in the form in which it has been published by the journal (for example, to upload the work to the online storage of the journal or publish it as part of a monograph), provided that the reference to the first publication of the work in this journal is included.







