Peritoneal remodeling and changes in its lymphoid component in experimental modeling of adhesion disease in rats
DOI:
https://doi.org/10.15587/2519-8025.2024.301278Keywords:
peritoneum, gastrointestinal tract, lymphocytes, immunity, histological changes, rats, morphometry, microscopy, immune system, adhesion diseaseAbstract
Age changes, inflammatory processes, surgical interventions and heterogeneous pathological effects on the physiological processes of the peritoneum lead to certain changes in the structure of the components of the peritoneum, which leads to remodeling of the tissue structures of the abdominal cavity. According to the literature, the most frequent consequence of such remodeling of tissue structures of the peritoneum is the development of an adhesion process. To date, there are no data on the study of the lymphoid component of mesentery tissues, which is the goal of further research.
The purpose of the work: to study the process of remodeling of peritoneal tissue during experimental adhesion formation and the specificity of changes in its lymphoid component in rats compared to the norm.
Research materials and methods: preparation, macroscopic, microscopic, histological (production of film preparations), staining of preparations with hematoxylin and eosin, mathematical (morphometric grids - counting the number of immunocompetent cells per 1000 μm2 standard area), statistical processing according to Student.
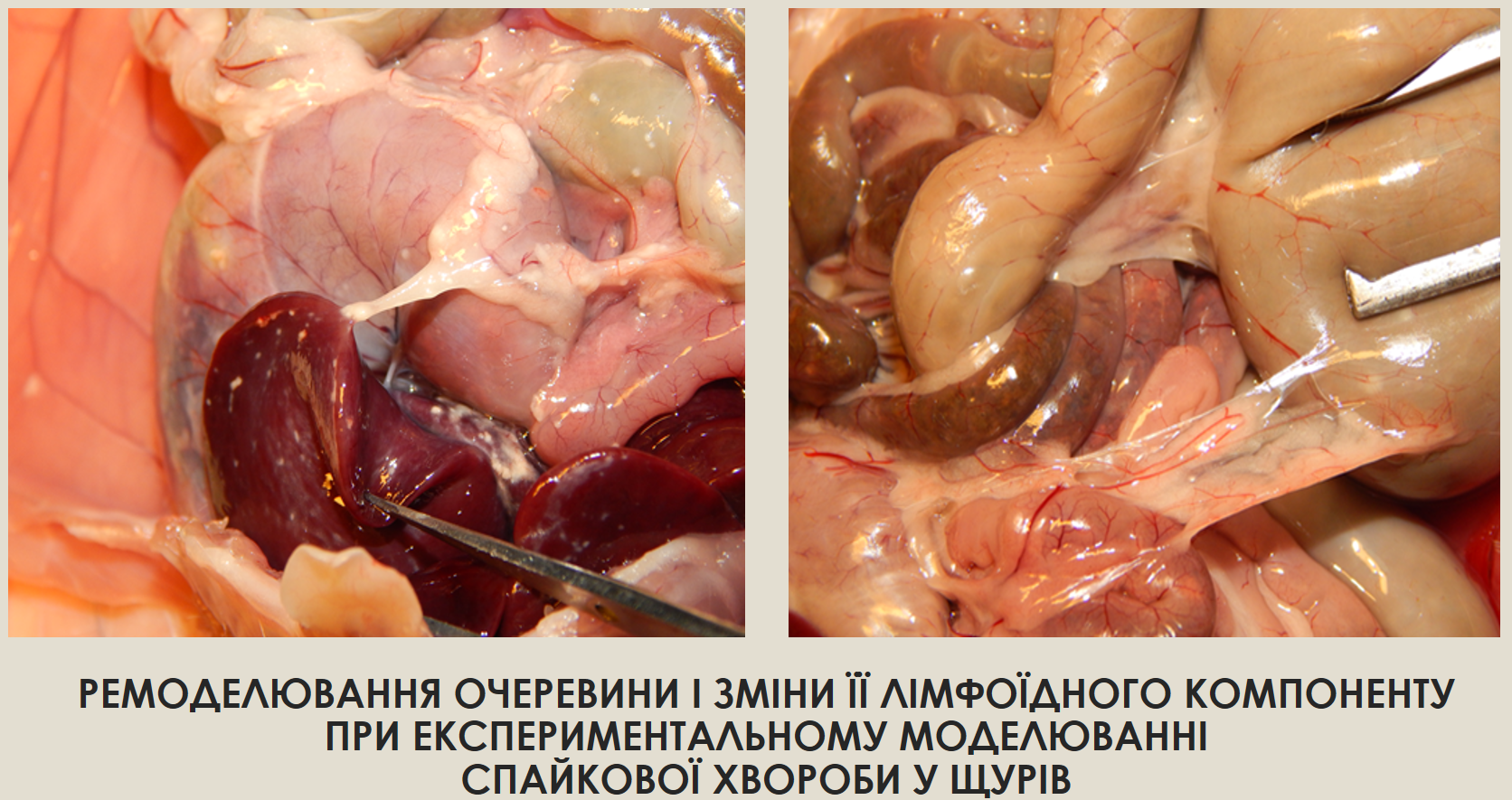
Results: experimental adhesion disease is characterized by a gradual process of remodeling of the mesenteric tissues of the small intestine and, as a result, the formation of connective tissue neoplasms. The mesentery of the small intestine loses its elasticity and mobility and thickens considerably. The process of experimental adhesion formation was accompanied by dynamic changes in the number of lymphocytes.
Conclusions: these structures are thin and homogeneous on the 7th day; hard, dense and granular on the 14th day; contain solid conglomerates of heterogeneous structures on the 21st day after talc injection. The number of lymphocytes in this structure gradually increases: on day 7 - by 2 % in animals of group II, on day 14 - by 30 % in animals of group III, and on day 21 - by 36 % in animals of group IV, compared to animals of the intact group
References
- Lichtenstein, G. R., Loftus, E. V., Isaacs, K. L., Regueiro, M. D., Gerson, L. B., Sands, B. E. (2018). ACG Clinical Guideline: Management of Crohn’s Disease in Adults. American Journal of Gastroenterology, 113 (4), 481–517. https://doi.org/10.1038/ajg.2018.27
- Eskildsen, M. P. R., Kalliokoski, O., Boennelycke, M., Lundquist, R., Settnes, A., Løkkegaard, E. (2022). Autologous Blood-Derived Patches Used as Anti-adhesives in a Rat Uterine Horn Damage Model. Journal of Surgical Research, 275, 225–234. https://doi.org/10.1016/j.jss.2022.02.008
- Hryn, V. H. (2018). General anatomical characteristics of small intestine in white rats. Actual Problems of the Modern Medicine: Bulletin of Ukrainian Medical Stomatological Academy, 18 (4), 88–93. https://doi.org/10.31718/2077-1096.18.4.88
- Krishnan, V., Tallapragada, S., Schaar, B., Kamat, K., Chanana, A. M., Zhang, Y. et al. (2020). Omental macrophages secrete chemokine ligands that promote ovarian cancer colonization of the omentum via CCR1. Communications Biology, 3 (1), 524–529. https://doi.org/10.1038/s42003-020-01246-z
- Bukata, V. V. (2017). Experimental Research Of Efficient Use Of Barrier Methods For Preventing Adhesions In The Abdominal Cavity. Hospital Surgery. Journal Named by L. Ya. Kovalchuk, 1, 58–64. https://doi.org/10.11603/2414-4533.2017.1.7337
- Ksonz, I. V. (2015). Clinical effectiveness of anti-adhesive drugs in treatment and prevention of adhesive intestinal obstruction in children. Aktualni problemy suchasnoi medytsyny: Visnyk ukrainskoi medychnoi stomatolohichnoi akademii, 15 (3), 125–197.
- Ksyonz, I. V., Kostylenko, Y., Liakhovskyi, V. I., Konoplitskyi, V. S., Maksimovskyi, V. Y. (2023). Milky spots in the greater omentum. Actual Problems of the Modern Medicine: Bulletin of Ukrainian Medical Stomatological Academy, 23 (2.2), 135–140. https://doi.org/10.31718/2077-1096.23.2.2.135
- Marushko, Y., Hyshchak, T., Chabanovich, O. (2021). The Main Mechanisms of the Effect of Intestinal Microflora on the Immune System and Their Importance in Clinical Practice. Family Medicine, 4, 19–27. https://doi.org/10.30841/2307-5112.4.2021.249409
- Yushkov, B., Sarapultsev, A., Sarapultsev, G. (2020). Major Characteristics of Experimental Models of Abdominal Adhesions. Journal of Experimental and Clinical Surgery, 13 (2), 157–162. https://doi.org/10.18499/2070-478x-2020-13-2-157-162
- Paidarkina, A. (2023). Problema vyboru eksperymentalnoi modeli spaikovoi khvoroby. Moloda Nauka-2023. Zaporizhzhia, 257–259.
- Paidarkina, A., Kushch, O. (2023) Study of the morphological features of the peritoneum of white rats and the method of its extraction. Morphologia, 17 (3), 163–167.
- Terri, M., Trionfetti, F., Montaldo, C., Cordani, M., Tripodi, M., Lopez-Cabrera, M., Strippoli, R. (2021). Mechanisms of Peritoneal Fibrosis: Focus on Immune Cells–Peritoneal Stroma Interactions. Frontiers in Immunology, 12. https://doi.org/10.3389/fimmu.2021.607204
- Melnichenko, M. G., Kvashnina, A. A. (2019). Peritoneal regeneration and pathogenesis of postoperative peritoneal adhesions formation. Surgery of Ukraine, 3, 88–93. https://doi.org/10.30978/su2019-3-88
- Murando, F., Peloso, A., & Cobianchi, L. (2019). Experimental Abdominal Sepsis: Sticking to an Awkward but Still Useful Translational Model. Mediators of Inflammation, 2019, 1–8. https://doi.org/10.1155/2019/8971036
- Stepanchuk, A. P., Fedorchenko, I. L., Tarasenko, Ya. A., Tykhonova, O. O., Filenko, B. M. (2021). Histostructure of the Normal Human Greater Omentum and in Peritonitis. Ukrainian Journal of Medicine, Biology and Sports, 6 (5), 127–133. https://doi.org/10.26693/jmbs06.05.127
- Hu, Q., Xia, X., Kang, X., Song, P., Liu, Z., Wang, M., Guan, W., Liu, S. (2021). A review of physiological and cellular mechanisms underlying fibrotic postoperative adhesion. International Journal of Biological Sciences, 17 (1), 298–306. https://doi.org/10.7150/ijbs.54403
- Khashchuk, V. S. (2021) Mechanisms of adhesive process development in peritoneal cavity (literature review). Klinichna ta eksperymentalʹna patolohiya, 20 (4 (78)), 137–145.
- Isaza-Restrepo, A., Martin-Saavedra, J. S., Velez-Leal, J. L., Vargas-Barato, F., Riveros-Dueñas, R. (2018). The Peritoneum: Beyond the Tissue – A Review. Frontiers in Physiology, 9, 738–743. https://doi.org/10.3389/fphys.2018.00738
- Cleypool, C. G. J., Schurink, B., van der Horst, D. E. M., Bleys, R. L. A. W. (2019). Sympathetic nerve tissue in milky spots of the human greater omentum. Journal of Anatomy, 236 (1), 156–164. https://doi.org/10.1111/joa.13077
- Schurink, B., Cleypool, C. G. J., Bleys, R. L. A. W. (2019). A rapid and simple method for visualizing milky spots in large fixed tissue samples of the human greater omentum. Biotechnic & Histochemistry, 94 (6), 429–434. https://doi.org/10.1080/10520295.2019.1583375
- Maksymenko, O. S., Hryn, V. H. (2023). The Greater Omentum of White Rats: Structural and Functional Characteristics and its Role in Peritonitis. Ukrainian Journal of Medicine, Biology and Sport, 8 (1), 22–29. https://doi.org/10.26693/jmbs08.01.022
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2024 Anastasia Paidarkina, Oksana Kushch

This work is licensed under a Creative Commons Attribution 4.0 International License.
Our journal abides by the Creative Commons CC BY copyright rights and permissions for open access journals.
Authors, who are published in this journal, agree to the following conditions:
1. The authors reserve the right to authorship of the work and pass the first publication right of this work to the journal under the terms of a Creative Commons CC BY, which allows others to freely distribute the published research with the obligatory reference to the authors of the original work and the first publication of the work in this journal.
2. The authors have the right to conclude separate supplement agreements that relate to non-exclusive work distribution in the form in which it has been published by the journal (for example, to upload the work to the online storage of the journal or publish it as part of a monograph), provided that the reference to the first publication of the work in this journal is included.







