Вплив складу емульгаторів та дисперсійного середовища на властивості основ для м’яких лікарських засобів
DOI:
https://doi.org/10.15587/2519-4852.2022.266001Ключові слова:
цетостеариловий спирт (CSA), пропіленгліколь (PG), основа, спіновий зонд, реопараметри, вивільнення в дослідах in vitroАнотація
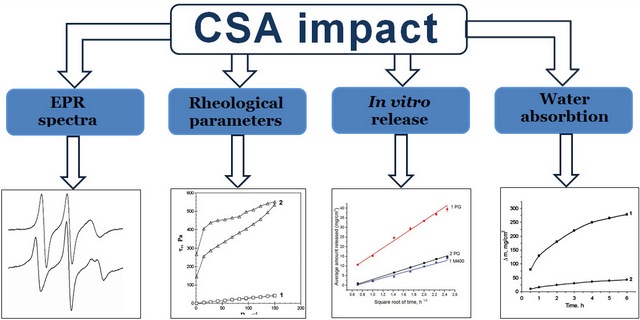
Мета. Дослідити вплив цетостеарилового спирту (CSA) на реологічні властивості основ з різними дисперсійними середовищами, вивільнення з них пропіленгліколю (PG) та здатність цих основ до абсорбції води.
Матеріали та методи. Досліджували: міцели неіонної ПАР та її агрегати з CSA у змішаному розчиннику, де переважає структура води; змішаний розчинник PG – макрогол 400 (М400); гідрофільні основи-носії з різним дисперсійним середовищем. Дослідження проводили методом спінових зондів з використанням зонда, що моделює катіонну ПАР, та методом ротаційної віскозиметрії. Мікроструктуру основ досліджували методом оптичної мікроскопії. Вивільнення в дослідах in vitro PG і М400 із розчинів та основ проводили з використанням вертикальних дифузійних камер. Вміст PG і М400 в діалізаті визначали методом газової хроматографії за валідованими методиками. Абсорбцію води розчинами та основами визначали методом діалізу крізь мембрану.
Результати. CSA, що входить до складу основ у певних співвідношеннях з ПАР, є значущим фактором для підвищення їх реопараметрів, зниження параметрів вивільнення PG в дослідах in vitro, а також зменшення абсорбції води. Механізми такого впливу є різними для основ з різною структурою дисперсійного середовища. В основах, де переважає структура води, в надмолекулярних структурах ПАР і CSA відбувається латеральне розділення фаз з утворенням рідких доменів ПАР та твердих доменів CSA, що сприяють формуванню коагуляційних структур. В змішаному неводному розчиннику PG – М400 міцели ПАР і сумісні агрегати із молекул ПАР і CSA не утворюються; ПАР і CSA при 25 оС окремо стають дисперсними фазами суспензій, що сприяє утворенню гелів. При введенні CSA у водний розчин полоксамеру 338, PG, М400 і катіонної ПАР змінюється тип течії та підвищуються реопараметри, що приводить до зменшення швидкості та ступеня вивільнення PG і М400, а також здатності до абсорбції води. Швидкість та ступінь вивільнення PG з розчину є більшими порівняно з М400.
Висновки. Введення CSA у комбінації з ПАР до складу основ для МЛЗ є значущим фактором для модифікації їх реопараметрів, кінетики вивільнення з них PG та абсорбції води в дослідах in vitro. Механізми такого впливу є різними і залежать від складу та структури дисперсійного середовища основи
Посилання
- Buckingham, R. (Ed.) (2020). Martindale: The Complete Drug Reference. London: Pharmaceutical Press, 4912.
- Ilić, T., Pantelić, I., Savić, S. (2021). The Implications of Regulatory Framework for Topical Semisolid Drug Products: From Critical Quality and Performance Attributes towards Establishing Bioequivalence. Pharmaceutics, 13 (5), 710. doi: https://doi.org/10.3390/pharmaceutics13050710
- Shanley, A. (2016). Topical Formulation: Moving from Art to Science. APIs, Excipients, and Manufacturing 2016 Supplement to Pharmaceutical Technology, 40 (9).
- Bezuglaya, E., Lyapunov, N., Lysokobylka, O., Liapunov, O., Klochkov, V., Grygorova, H., Liapunova, A. (2021). Interaction of surfactants with poloxamers 338 and its effect on some properties of cream base. ScienceRise: Pharmaceutical Science, 6 (34), 4–19. doi: https://doi.org/10.15587/2519-4852.2021.249312
- Wu, K., Yeoh, T., Hsieh, Y. L., Osborne, D. W.; Langley, N., Michniak-Kohn, B., Osborne, D. W. (Eds.) (2019). Quality Assesment of API in Topical Drug Products. The Role of Microstructure in Topical Drug Product Development. Cham: Springer, 36, 109–154. doi: http://doi.org/10.1007/978-3-030-17355-5_4
- Guideline on the Investigation of Bioequivalence (2010). CPMP/EWP/QWP/1401/98 Rev. 1 / Corr **. Available at: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-investigation-bioequivalence-rev1_en.pdf
- Raghavan, L., Brown, M., Michniak-Kohn, B., Sammeta, S.; Langley, N., Michniak-Kohn, B., Osborne, D. W. (Eds.) (2019). Quality Assesment of API in Topical Drug Products. The Role of Microstructure in Topical Drug Product Development. Springer: Cham, 36, 47–87. doi: http://doi.org/10.1007/978-3-030-17355-5_2
- SUPAC-SS. Guidance for Industry Nonsterile Semisolid Dosage Forms. Scale-Up and Postapproval Changes: Chemistry, Manufacturing, and Controls; In Vitro Release Testing and In Vivo Bioequivalence Documentation (1997). Rockville: Center for Drug Evaluation and Research (CDER). Available at: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/supac-ss-nonsterile-semisolid-dosage-forms-scale-and-post-approval-changes-chemistry-manufacturing
- Draft guideline on quality and equivalence of topical products (2018). CHMP/QWP/708282/2018. Available at: www.ema.europa.eu/en/quality-equivalence-topical-products
- The United States Pharmacopoeia, 41 – NF 36 (2018). The United States Pharmacopoeial Convention. Rockville. Available at: https://www.worldcat.org/title/united-states-pharmacopeia-2018-usp-41-the-national-formulary-nf-36/oclc/1013752699
- Miranda, M., Veloso, C., Brown, M., C. Pais, A. A. C., Cardoso, C., Vitorino, C. (2022). Topical bioequivalence: Experimental and regulatory considerations following formulation complexity. International Journal of Pharmaceutics, 620, 121705. doi: https://doi.org/10.1016/j.ijpharm.2022.121705
- Pleguezuelos-Villa, M., Merino-Sanjuán, M., Hernández, M. J., Nácher, A., Peris, D., Hidalgo, I. et. al. (2019). Relationship between rheological properties, in vitro release and in vivo equivalency of topical formulations of diclofenac. International Journal of Pharmaceutics, 572, 118755. doi: https://doi.org/10.1016/j.ijpharm.2019.118755
- The European Pharmacopoeia (2019). European Directorate for the Quality of Medicines & HealthCare of the Council of Europe. Strasbourg, 5224.
- Bezuglaya, E., Ivashchenko, H., Lyapunov, N., Zinchenko, I., Liapunova, A., Stolper, Y. et. al. (2021). Study of factors affecting the in vitro release of diclofenac sodium from hypromelose-based gels. ScienceRise: Pharmaceutical Science, 5 (33), 12–31. doi: https://doi.org/10.15587/2519-4852.2021.243040
- Sheskey, P. J., Hancock, B. C., Moss, G. P., Goldfarb, D. J. (Ed.) (2020). Handbook of Pharmaceutical Excipients. London: Pharm. Press, 1296.
- D’souza, A. A., Shegokar, R. (2016). Polyethylene glycol (PEG): a versatile polymer for pharmaceutical applications. Expert Opinion on Drug Delivery, 13 (9), 1257–1275. doi: https://doi.org/10.1080/17425247.2016.1182485
- Bodratti, A., Alexandridis, P. (2018). Formulation of poloxamers for drug delivery. Journal of Functional Biomaterials, 9 (1). doi: https://doi.org/10.3390/jfb9010011
- Mangas-Sanjuán, V., Pleguezuelos-Villa, M., Merino-Sanjuán, M., Hernández, M. J., Nácher, A., García-Arieta, A. et. al. (2019). Assessment of the Inter-Batch Variability of Microstructure Parameters in Topical Semisolids and Impact on the Demonstration of Equivalence. Pharmaceutics, 11 (10), 503. doi: https://doi.org/10.3390/pharmaceutics11100503
- Miranda, M., Pais, A. A. C. C., Cardoso, C., Vitorino, C. (2019). aQbD as a platform for IVRT method development – A regulatory oriented approach. International Journal of Pharmaceutics, 572, 118695. doi: https://doi.org/10.1016/j.ijpharm.2019.118695
- Miranda, M., Cova, T., Augusto, C., Pais, A. A. C. C., Cardoso, C., Vitorino, C. (2020). Diving into Batch-to-Batch Variability of Topical Products-a Regulatory Bottleneck. Pharmaceutical Research, 37 (11). doi: https://doi.org/10.1007/s11095-020-02911-y
- Xu, Z., Mangas-Sanjuán, V., Merino-Sanjuán, M., Merino, V., García-Arieta, A. (2020). Influence of Inter- and Intra-Batch Variability on the Sample Size Required for Demonstration of Equivalent Microstructure of Semisolid Dosage Forms. Pharmaceutics, 12 (12), 1159. doi: https://doi.org/10.3390/pharmaceutics12121159
- Benaouda, F., Brown, M. B., Ganguly, S., Jones, S. A., Martin, G. P. (2012). Discriminating the Molecular Identity and Function of Discrete Supramolecular Structures in Topical Pharmaceutical Formulations. Molecular Pharmaceutics, 9 (9), 2505–2512. doi: http://doi.org/10.1021/mp300127f
- Miron, D. S., Rădulescu, F. Ștefan, Voicu, V. A., Mînea, A., Cardot, J.-M., Shah, V. P. (2021). Rheological and in vitro release measurements of manufactured acyclovir 5% creams: confirming sensitivity of the in vitro release. Pharmaceutical Development and Technology, 26 (7), 779–787. doi: https://doi.org/10.1080/10837450.2021.1945625
- Benaouda, F., Jones, S. A., Martin, G. P., Brown, M. B. (2015). Localized Epidermal Drug Delivery Induced by Supramolecular Solvent Structuring. Molecular Pharmaceutics, 13 (1), 65–72. doi: https://doi.org/10.1021/acs.molpharmaceut.5b00499
- Carrer, V., Alonso, C., Pont, M., Zanuy, M., Córdoba, M., Espinosa, S. et. al. (2019). Effect of propylene glycol on the skin penetration of drugs. Archives of Dermatological Research, 312 (5), 337–352. doi: https://doi.org/10.1007/s00403-019-02017-5
- Zhang, W., Harty, B., Zheng, Y., Zhang, Z., Li, X., Wang, D., Kohane, D. S. (2021). Permeation of polyethylene glycols across the tympanic membrane. Giant, 6, 100057. doi: https://doi.org/10.1016/j.giant.2021.100057
- Laffleur, F., Pschick, S., Barthelmes, J., Hauptstein, S., Bernkop-Schnurch, A. (2018). Impact of Surfactants on Skin Penetration of Dexpanthenol. Current Drug Delivery, 15 (3), 351–356. doi: https://doi.org/10.2174/1567201814666170503142707
- Kováčik, A., Kopečná, M., Vávrová, K. (2020). Permeation enhancers in transdermal drug delivery: benefits and limitations. Expert Opinion on Drug Delivery, 17 (2), 145–155. doi: https://doi.org/10.1080/17425247.2020.1713087
- Liapunov, M. O., Ivanov, L. V., Bezuhla, O. P., Zhdanov, R. I., Tsymbal, L. V. (1992). Doslidzhennia ahrehativ poverkhnevo-aktyvnykh rechovyn (PAR) metodom spinovykh zondiv. Farmatsevtychnyi zhurnal, 5-6, 40–45.
- Derzhavna Farmakopeia Ukrainy. Tom 1 (2015). Kharkiv: Derzhavne pidpryiemstvo «Ukrainskyi naukovyi farmakopeinyi tsentr yakosti likarskykh zasobiv», 1128.
- Krasnoperova, A. P., Sytnik, O. Iu., Iukhno, G. D., Bezuglaia E. P., Liapunov, N. A., Krichevskii, A. O. (2002). Nekotorye zakonomernosti rastvoreniia i solvatatcii mikonazola v dvoinykh i troinykh smeshannykh rastvoriteliakh na osnove polietilenglikolia-400. Zhurnal prikladnoi khimii, 75 (12), 1972–1975.
- Berliner, L. (Ed.) (1979). Metod spinovykh metok. Teoriia i primenenie. Moscow: Mir, 635.
- Likhtenshtein, G. I. (1974). Metod spinovykh zondov v molekuliarnoi biologii, Moscow: Nauka, 256.
- Kuznetcov, A. N. (1976). Metod spinovogo zonda (Osnovy i primenenie). Moscow: Nauka, 210.
- Tiffner, K. I., Kanfer, I., Augustin, T., Raml, R., Raney, S. G., Sinner, F. (2018). A comprehensive approach to qualify and validate the essential parameters of an in vitro release test (IVRT) method for acyclovir cream, 5 %. International Journal of Pharmaceutics, 535 (1-2), 217–227. doi: https://doi.org/10.1016/j.ijpharm.2017.09.049
- Bezuglaya, E., Lyapunov, N., Bovtenko, V., Zinchenko, I., Stolper, Y. (2021). Study of pressurised metered dose inhalers for the purpose of standardization of quality attributes characterizing uniformity of dosing. ScienceRise: Pharmaceutical Science, 4 (32), 11–23. doi: https://doi.org/10.15587/2519-4852.2021.238294
- Note for Guidance on Validation of Analytical Procedures: Text and Methodology, Step 5 (1995). CPMP/ICH/381/95 (ICH Topic Q 2 (R1) Validation of Analytical Procedures: Text and Methodology).
- Ivanova, R., Alexandridis, P., & Lindman, B. (2001). Interaction of poloxamer block copolymers with cosolvents and surfactants. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 183-185, 41–53. doi: https://doi.org/10.1016/s0927-7757(01)00538-6
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2022 Nikolay Lyapunov, Elena Bezuglaya, Anna Liapunova, Igor Zinchenko, Oleksii Liapunov, Oleksii Lysokobylka, Yurij Stolper

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.







