Інгібітори SGLT-2 як потенційні антиконвульсанти: емпагліфлозин, але не дапагліфлозин, чинить виразний ефект і потенціює дію вальпроату натрію за пентилентетразолових судом
DOI:
https://doi.org/10.15587/2519-4852.2022.266065Ключові слова:
протиепілептичні препарати, ад’ювантні засоби, інгібітори SGLT-2, хемоіндуковані судоми, мишіАнотація
На шляху пошуку ефективних ад’ювантних препаратів для лікування епілепсії привертають увагу протидіабетичні засоби – інгібітори натрій-глюкозного контранспортера-2, який експресується не лише в нирках, а й у головному мозку. З попередніх досліджень відомо, що дапагліфлозин покращує електроенцефалографічні показники щурів із моделлю пентилентетразолових судом. Потребує з’ясування антиконвульсантний потенціал інших препаратів цієї групи.
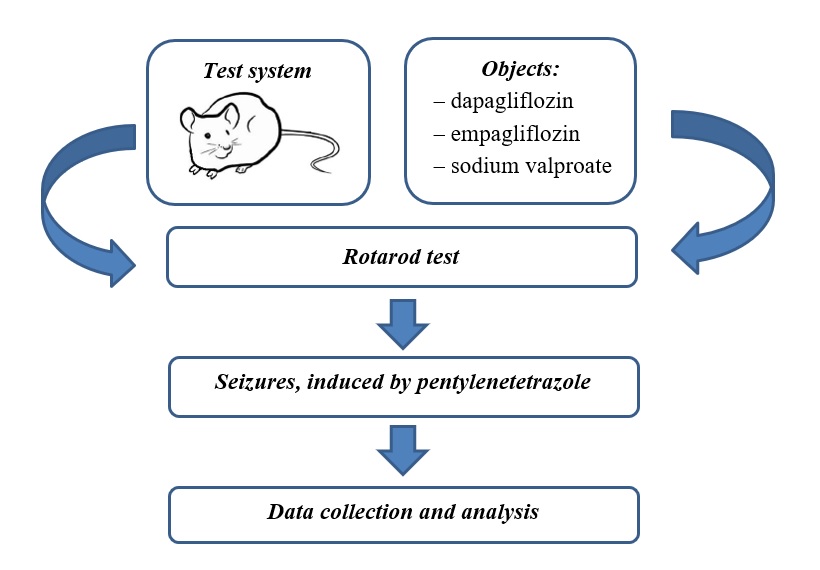
Метою дослідження була порівняльна оцінка впливу емпагліфлозину та дапагліфлозину per se і в комбінації з вальпроатом натрію на перебіг пентилентетразолових судом, а також на м’язовий тонус і координацію рухів у мишей.
Матеріали та методи. Досліди виконано на 42 білих рандомбредних мишах масою 24-28 г. Емпагліфлозин (20 мг/кг) і дапагліфлозин (50 мг/кг) вводили внутрішньошлунково протягом 3 днів. В аналогічному режимі вводили класичний антиконвульсант вальпроат натрію (150 мг/кг) per se і в комбінації із зазначеними препаратами. На другий день через 30 хв після введення досліджуваних препаратів визначали їхній вплив на м’язовий тонус і координацію рухів у тесті стрижня, що обертається. На третій день через 30 хв після останнього введення препаратів досліджували їхній вплив на перебіг судом, які моделювали пентилентетразолом (80 мг/кг підшкірно).
Результати. Вперше встановлено виразний протисудомний ефект емпагліфлозину як за ізольованого використання (достовірне збільшення латентного періоду судом і зменшення летальності на 43 %), так і особливо в комбінації з вальпроатом натріют (достовірне збільшення латентного періоду, зменшення кількості та тяжкості судом і зниження летальності на 83 %), а також відсутність міорелаксантного ефекту в обох випадках. У дапагліфлозину не виявлено ані власних антиконвульсивних властивостей, ані впливу на дію вальпроату натрію, проте цей препарат викликав міорелаксацію, особливо за комбінації з вальпроатом натрію.
Висновки. Результати дають підставу для висновку, що емпагліфлозин, на відміну від дапагліфлозину, має високий потенціал як ад’ювантний лікарський засіб у лікуванні епілепсії, оскільки він підвищує ефективність класичного протисудомного препарату вальпроату натрію без побічної міорелаксантної дії
Спонсор дослідження
- No. 0120U102460 "Rationale for improving the treatment of multidrug-resistant epilepsy through the combined use of classic anticonvulsants with other medicines" (2020/2022), which is performed at the expense of the State Budget of Ukraine.
Посилання
- Scheffer, I. E., Berkovic, S., Capovilla, G., Connolly, M. B., French, J., Guilhoto, L. et. al. (2017). ILAE classification of the epilepsies: Position paper of the ILAE Commission for Classification and Terminology. Epilepsia, 58 (4), 512–521. doi: https://doi.org/10.1111/epi.13709
- Abramovici, S., Bagić, A. (2016). Epidemiology of epilepsy. Handbook of clinical neurology, 138, 159–171. doi: https://doi.org/10.1016/B978-0-12-802973-2.00010-0
- Kalilani, L., Sun, X., Pelgrims, B., Noack-Rink, M., Villanueva, V. (2018). The epidemiology of drug-resistant epilepsy: A systematic review and meta-analysis. Epilepsia, 59 (12), 2179–2193. doi: https://doi.org/10.1111/epi.14596
- Copeland, L., Meek, A., Kerr, M., Robling, M., Hood, K., McNamara, R. (2017). Measurement of side effects of anti-epileptic drugs (AEDs) in adults with intellectual disability: A systematic review. Seizure, 51, 61–73. doi: https://doi.org/10.1016/j.seizure.2017.07.013
- Radu, B. M., Epureanu, F. B., Radu, M., Fabene, P. F., Bertini, G. (2017). Nonsteroidal anti-inflammatory drugs in clinical and experimental epilepsy. Epilepsy Research, 131, 15–27. doi: https://doi.org/10.1016/j.eplepsyres.2017.02.003
- Dhir, A. (2018). An update of cyclooxygenase (COX)-inhibitors in epilepsy disorders. Expert Opinion on Investigational Drugs, 28 (2), 191–205. doi: https://doi.org/10.1080/13543784.2019.1557147
- Zaccara, G., Lattanzi, S. (2019). Comorbidity between epilepsy and cardiac arrhythmias: Implication for treatment. Epilepsy & Behavior, 97, 304–312. doi: https://doi.org/10.1016/j.yebeh.2019.05.038
- Borowicz-Reutt, K. K. (2022). Effects of Antiarrhythmic Drugs on Antiepileptic Drug Action –A Critical Review of Experimental Findings. International Journal of Molecular Sciences, 23 (5), 2891. doi: https://doi.org/10.3390/ijms23052891
- Sawicka, K. M., Wawryniuk, A., Zwolak, A., Daniluk, J., Szpringer, M., Florek-Luszczki, M. et. al. (2017). Influence of Ivabradine on the Anticonvulsant Action of Four Classical Antiepileptic Drugs Against Maximal Electroshock-Induced Seizures in Mice. Neurochemical Research, 42 (4), 1038–1043. doi: https://doi.org/10.1007/s11064-016-2136-1
- Togha, M., Akhondzadeh, S., Motamedi, M., Ahmadi, B., Razeghi, S. (2007). Allopurinol as Adjunctive Therapy in Intractable Epilepsy: A Double-blind and Placebo-controlled Trial. Archives of Medical Research, 38 (3), 313–316. doi: https://doi.org/10.1016/j.arcmed.2006.10.010
- Quintana-Pájaro, L. D. J., Ramos-Villegas, Y., Cortecero-Sabalza, E., Joaquim, A. F., Agrawal, A., Narvaez-Rojas, A. R., Moscote-Salazar, L. R. (2018). The Effect of Statins in Epilepsy: A Systematic Review. Journal of Neurosciences in Rural Practice, 9 (4), 478–486. doi: https://doi.org/10.4103/jnrp.jnrp_110_18
- Scicchitano, F., Constanti, A., Citraro, R., Sarro, G., Russo, E. (2015). Statins and epilepsy: preclinical studies, clinical trials and statin-anticonvulsant drug interactions. Current Drug Targets, 16 (7), 747–756. doi: https://doi.org/10.2174/1389450116666150330114850
- Tawfik, K. M., Moustafa, Y. M., El-Azab, M. F. (2018). Neuroprotective mechanisms of sildenafil and selenium in PTZ-kindling model: Implications in epilepsy. European Journal of Pharmacology, 833, 131–144. doi: https://doi.org/10.1016/j.ejphar.2018.05.035
- Aygun, H., Bilginoglu, A. (2019). Effect of tadalafil and nitric oxide agonist sodium nitroprusside on penicillin-induced epileptiform activity. Neurological Research, 42 (1), 39–46. doi: https://doi.org/10.1080/01616412.2019.1703166
- Tsyvunin, V., Shtrygol’, S., Shtrygol’, D. (2020). Digoxin enhances the effect of antiepileptic drugs with different mechanism of action in the pentylenetetrazole-induced seizures in mice. Epilepsy Research, 167, 106465. doi: https://doi.org/10.1016/j.eplepsyres.2020.106465
- Tsyvunin, V., Shtrygol’, S., Shtrygol', D., Mishchenko, M., Kapelka, I. Taran, A. (2021). Digoxin potentiates the anticonvulsant effect of carbamazepine and lamotrigine against experimental seizures in mice. Thai Journal of Pharmaceutical Sciences, 45 (3), 165–171.
- Tsyvunin, V., Shtrygol’, S., Havrylov, I., Shtrygol’, D. (2021). Low-dose digoxin enhances the anticonvulsive potential of carbamazepine and lamotrigine in chemo-induced seizures with different neurochemical mechanisms. ScienceRise: Pharmaceutical Science, 6 (34), 58–65. doi: https://doi.org/10.15587/2519-4852.2021.249375
- Tsyvunin, V., Shtrygol, S., Mishchenko, M., Shtrygol, D. (2022). Digoxin at sub-cardiotonic dose modulates the anticonvulsive potential of valproate, levetiracetam and topiramate in experimental primary generalized seizures. Česká a Slovenská Farmacie, 71 (2), 76–86. doi: https://doi.org/10.5817/csf2022-2-76
- Tentolouris, A., Vlachakis, P., Tzeravini, E., Eleftheriadou, I., Tentolouris, N. (2019). SGLT2 Inhibitors: A Review of Their Antidiabetic and Cardioprotective Effects. International Journal of Environmental Research and Public Health, 16 (16), 2965. doi: https://doi.org/10.3390/ijerph16162965
- Zinman, B., Wanner, C., Lachin, J. M., Fitchett, D., Bluhmki, E., Hantel, S. et. al. (2015). Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. New England Journal of Medicine, 373 (22), 2117–2128. doi: https://doi.org/10.1056/nejmoa1504720
- Neal, B., Perkovic, V., Mahaffey, K. W., de Zeeuw, D., Fulcher, G., Erondu, N. et. al. (2017). Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. New England Journal of Medicine, 377 (7), 644–657. doi: https://doi.org/10.1056/nejmoa1611925
- Yu, A. S., Hirayama, B. A., Timbol, G., Liu, J., Diez-Sampedro, A., Kepe, V. et. al. (2013). Regional distribution of SGLT activity in rat brain in vivo. American Journal of Physiology-Cell Physiology, 304 (3), C240–C247. doi: https://doi.org/10.1152/ajpcell.00317.2012
- Wright, E. M., Loo, D. D. F., Hirayama, B. A. (2011). Biology of Human Sodium Glucose Transporters. Physiological Reviews, 91 (2), 733–794. doi: https://doi.org/10.1152/physrev.00055.2009
- Melo, I. S., Santos, Y. M. O., Costa, M. A., Pacheco, A. L. D., Silva, N. K. G. T., Cardoso-Sousa, L. et. al. (2016). Inhibition of sodium glucose cotransporters following status epilepticus induced by intrahippocampal pilocarpine affects neurodegeneration process in hippocampus. Epilepsy & Behavior, 61, 258–268. doi: https://doi.org/10.1016/j.yebeh.2016.05.026
- Erdogan, M. A., Yusuf, D., Christy, J., Solmaz, V., Erdogan, A., Taskiran, E., Erbas, O. (2018). Highly selective SGLT2 inhibitor dapagliflozin reduces seizure activity in pentylenetetrazol-induced murine model of epilepsy. BMC Neurology, 18 (1). doi: https://doi.org/10.1186/s12883-018-1086-4
- Blunck, J. R., Newman, J. W., Fields, R. K., Croom, J. E. (2018). Therapeutic augmentation of ketogenic diet with a sodium-glucose cotransporter 2 inhibitor in a super-refractory status epilepticus patient. Epilepsy & Behavior Case Reports, 10, 61–64. doi: https://doi.org/10.1016/j.ebcr.2018.05.002
- Bodenant, M., Moreau, C., Sejourné, C., Auvin, S., Delval, A., Cuisset, J. M. et. al. (2008). Interest of the ketogenic diet in a refractory status epilepticus in adults. Revue neurologique, 164 (2), 194–199. doi: https://doi.org/10.1016/j.neurol.2007.08.009
- Ogawa, W., Sakaguchi, K. (2015). Euglycemic diabetic ketoacidosis induced by SGLT2 inhibitors: possible mechanism and contributing factors. Journal of Diabetes Investigation, 7 (2), 135–138. doi: https://doi.org/10.1111/jdi.12401
- Lidster, K., Jefferys, J. G., Blümcke, I., Crunelli, V., Flecknell, P., Frenguelli, B. G. et. al. (2016). Opportunities for improving animal welfare in rodent models of epilepsy and seizures. Journal of Neuroscience Methods, 260, 2–25. doi: https://doi.org/10.1016/j.jneumeth.2015.09.007
- Deacon, R. M. J. (2013). Measuring Motor Coordination in Mice. Journal of Visualized Experiments, 75. doi: https://doi.org/10.3791/2609
- Hock, F. J. (Ed.) (2016). Drug Discovery and Evaluation: Pharmacological Assays. Springer International Publishing, 4314. doi: http://doi.org/10.1007/978-3-319-05392-9
- Glantc, S. (1999). Mediko-biologicheskaia statistika. Moscow: Praktika, 459.
- Nambu, H., Takada, S., Fukushima, A., Matsumoto, J., Kakutani, N., Maekawa, S. et. al. (2020). Empagliflozin restores lowered exercise endurance capacity via the activation of skeletal muscle fatty acid oxidation in a murine model of heart failure. European Journal of Pharmacology, 866, 172810. doi: https://doi.org/10.1016/j.ejphar.2019.172810
- Arab, H. H., Safar, M. M., Shahin, N. N. (2021). Targeting ROS-Dependent AKT/GSK-3β/NF-κB and DJ-1/Nrf2 Pathways by Dapagliflozin Attenuates Neuronal Injury and Motor Dysfunction in Rotenone-Induced Parkinson’s Disease Rat Model. ACS Chemical Neuroscience, 12 (4), 689–703. doi: https://doi.org/10.1021/acschemneuro.0c00722
- Yun, C., Xuefeng, W. (2013). Association Between Seizures and Diabetes Mellitus: A Comprehensive Review of Literature. Current Diabetes Reviews, 9 (4), 350–354. doi: https://doi.org/10.2174/15733998113099990060
- Meidenbauer, J. J., Roberts, M. F. (2014). Reduced glucose utilization underlies seizure protection with dietary therapy in epileptic EL mice. Epilepsy & Behavior, 39, 48–54. doi: https://doi.org/10.1016/j.yebeh.2014.08.007
- Rovet, J. F., Ehrlich, R. M. (1999). The effect of hypoglycemic seizures on cognitive function in children with diabetes: A 7-year prospective study. The Journal of Pediatrics, 134 (4), 503–506. doi: https://doi.org/10.1016/s0022-3476(99)70211-8
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2022 Vadim Tsyvunin, Sergiy Shtrygol’, Ihnat Havrylov, Diana Shtrygol’, Artur Reus

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.







