Одержання субстанції еноксапарину натрію, еквівалентної оригінальним Clexane® та Lovenox®. Підбір технологічних параметрів ключової стадії синтезу
DOI:
https://doi.org/10.15587/2519-4852.2023.277735Ключові слова:
еноксапарин, низькомолекулярний гепарин, технологічні параметри, композиційний аналіз, HSQC, ексклюзійна хроматографія, відновлені та невідновлені залишкиАнотація
Мета: проведення ключової стадії синтезу для отримання субстанції, еквівалентної до оригінаних препаратів Clexane® та Lovenox® шляхом визначення критичних з огляду формування молекули технологічних параметрів синтезу та вивчення кореляції між структурними характеристиками зразків Еноксапарину та експериментальними умовами технологічного процесу.
Матеріали та методи: зразки субстанції Еноксапарин натрію були синтезовані згідно з методикою, описаною в патенті, а також з варіацією обраних критичних технологічних параметрів. Отримані зразки Еноксапарину натрію були проаналізовані згідно фармакопейних вимог, а також за нефармакопейними методами, такими як двомірна ЯМР спектроскопія та ексклюзійна хроматографія для детальної структурної характеризації молекули.
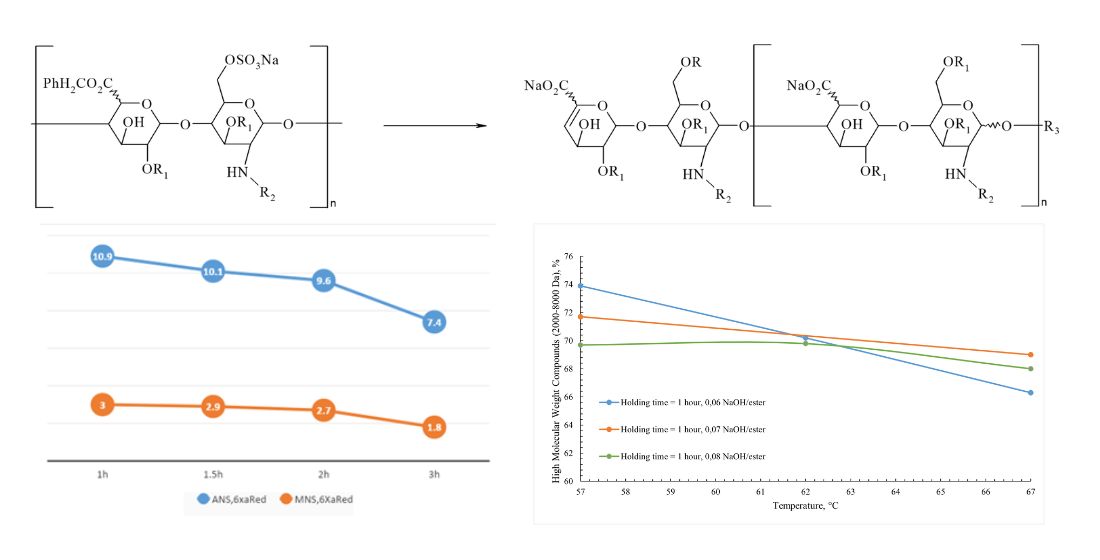
Результати: проведено визначення та варіацію критичних з огляду на формування молекули технологічних параметрів, таких як температура, кількість лугу для реакції деполімеризації та час витримки реакційнї маси. Напрацьовано зразки Еноксапарину натрію згідно обраних параметрів та проведено деталізований аналіз структури отриманих зразків з наступним порівнянням з оригінальними Clexane® та Lovenox®. Встановлено, що при збільшенні температури реакційної маси, кількості лугу та часу витримки окремо та в комбінації, збільшується ступінь деполімеризації, що робить композиційний склад молекули незбалансованим у порівнянні з оригінальними препаратами Clexane® та Lovenox®.
Висновки: В результаті проведених експериментів здійснено оцінку та визначено технологічні параметри синтезу зразку Еноксапарину натрію, що дозволяють отримувати субстанцію, співставну з оригінатором за хімічною структурою (співвідношення луг/безиловий естер гепарину 0,06; температура – 57 °C, час витримки реакційної суміші – 1,5 години)
Спонсор дослідження
- JSC Farmak
Посилання
- Taylor, A., Martinez-Quinones, P., Huang, E., Robinson, T., White, C. Q. (2022). Effective use of weight-based enoxaparin for deep vein thrombosis chemoprophylaxis in patients with traumatic brain injury. The American Journal of Surgery, 223 (1), 146–150. doi: https://doi.org/10.1016/j.amjsurg.2021.07.030
- Billett, H. H., Reyes-Gil, M., Szymanski, J., Ikemura, K., Stahl, L. R., Lo, Y. et al. (2020). Anticoagulation in COVID-19: Effect of Enoxaparin, Heparin, and Apixaban on Mortality. Thrombosis and Haemostasis, 120 (12), 1691–1699. doi: https://doi.org/10.1055/s-0040-1720978
- Drago, F., Gozzo, L., Li, L., Stella, A., Cosmi, B. (2020). Use of Enoxaparin to Counteract COVID-19 Infection and Reduce Thromboembolic Venous Complications: A Review of the Current Evidence. Frontiers in Pharmacology, 11. doi: https://doi.org/10.3389/fphar.2020.579886
- Casu, B. (2005). Structure and Active Domains of Heparin. Chemistry and Biology of Heparin and Heparan Sulfate, 1–28. doi: https://doi.org/10.1016/b978-008044859-6/50002-2
- Alekseeva, A., Elli, S., Cosentino, C., Torri, G., Naggi, A. (2014). Susceptibility of enoxaparin reducing end amino sugars to periodate oxidation. Carbohydrate Research, 400, 33–43. doi: https://doi.org/10.1016/j.carres.2014.08.016
- Mourier, P. A. J., Agut, C., Souaifi-Amara, H., Herman, F., Viskov, C. (2015). Analytical and statistical comparability of generic enoxaparins from the US market with the originator product. Journal of Pharmaceutical and Biomedical Analysis, 115, 431–442. doi: https://doi.org/10.1016/j.jpba.2015.07.038
- Weitz, J. I. (1997). Low-Molecular-Weight Heparins. New England Journal of Medicine, 337 (10), 688–698. doi: https://doi.org/10.1056/nejm199709043371007
- Langeslay, D. J., Beecher, C. N., Dinges, M. M., Larive, C. K. (2013). Glycosaminoglycan Structural Characterization. EMagRes. doi: https://doi.org/10.1002/9780470034590.emrstm1316
- Wang, T., Liu, L., Voglmeir, J. (2020). Chemoenzymatic synthesis of ultralow and low-molecular weight heparins. Biochimica et Biophysica Acta (BBA) – Proteins and Proteomics, 1868 (2), 140301. doi: https://doi.org/10.1016/j.bbapap.2019.140301
- Mourier, P. A. J., Herman, F., Sizun, P., Viskov, C. (2016). Analytical comparison of a US generic enoxaparin with the originator product: The focus on comparative assessment of antithrombin-binding components. Journal of Pharmaceutical and Biomedical Analysis, 129, 542–550. doi: https://doi.org/10.1016/j.jpba.2016.07.033
- Iqbal, Z., Sadaf, S. (2022). Commercial Low Molecular Weight Heparins – Patent Ecosystem and Technology Paradigm for Quality Characterization. Journal of Pharmaceutical Innovation. doi: https://doi.org/10.1007/s12247-022-09665-7
- Information on Adverse Event Reports and Heparin. Available at: http://wayback.archive-it.org/7993/20161024045926/http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm112669.htm
- Shriver, Z., Sasisekharan, R. (2009). From crisis to opportunity: A perspective on the heparin crisis. Thrombosis and Haemostasis, 102 (11), 854–858. doi: https://doi.org/10.1160/th09-02-0083
- Guerrini, M., Beccati, D., Shriver, Z., Naggi, A., Viswanathan, K., Bisio, A. et al. (2008). Oversulfated chondroitin sulfate is a contaminant in heparin associated with adverse clinical events. Nature Biotechnology, 26 (6), 669–675. doi: https://doi.org/10.1038/nbt1407
- Szajek, A. Y., Chess, E., Johansen, K., Gratzl, G., Gray, E., Keire, D. et al. (2016). The US regulatory and pharmacopeia response to the global heparin contamination crisis. Nature Biotechnology, 34 (6), 625–630. doi: https://doi.org/10.1038/nbt.3606
- Ye, H., Toby, T. K., Sommers, C. D., Ghasriani, H., Trehy, M. L., Ye, W. et al. (2013). Characterization of currently marketed heparin products: Key tests for LMWH quality assurance. Journal of Pharmaceutical and Biomedical Analysis, 85, 99–107. doi: https://doi.org/10.1016/j.jpba.2013.06.033
- Guideline on non-clinical and clinical development of similar biological medicinal products containing lowmolecular-weight-heparins (2016). Available at: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-non-clinical-clinical-development-similar-biological-medicinal-products-containing-low_en.pdf
- ImmunogenicityRelated Considerations for Low Molecular Weight Heparin (2016). Pharmaceutical Quality/CMC. Available at: https://www.fda.gov/files/drugs/published/Immunogenicity-Related-Considerations-for-Low-Molecular-Weight-Heparin-Guidance-for-Industry.pdf
- Ofosu, F. A. (2010). The United States Food and Drugs Administration Approves a Generic Enoxaparin. Clinical and Applied Thrombosis/Hemostasis, 17 (1), 5–8. doi: https://doi.org/10.1177/1076029610389028
- Guerrini, M., Elli, S., Gaudesi, D., Torri, G., Casu, B., Mourier, P. et al. (2010). Effects on Molecular Conformation and Anticoagulant Activities of 1,6-Anhydrosugars at the Reducing Terminal of Antithrombin-Binding Octasaccharides Isolated from Low-Molecular-Weight Heparin Enoxaparin. Journal of Medicinal Chemistry, 53 (22), 8030–8040. doi: https://doi.org/10.1021/jm100771s
- Guan, Y., Xu, X., Liu, X., Sheng, A., Jin, L., Linhardt, R. J., Chi, L. (2016). Comparison of Low-Molecular-Weight Heparins Prepared From Bovine Lung Heparin and Porcine Intestine Heparin. Journal of Pharmaceutical Sciences, 105 (6), 1843–1850. doi: https://doi.org/10.1016/j.xphs.2016.03.037
- Debrie, R. (1995). Pat. US5389618A. Mixtures of particular LMW heparinic polysaccharides for the prophylaxis/treatment of acute thrombotic events. published: 14.02.1995.
- Adiguzel, C., Jeske, W. P., Hoppensteadt, D., Walenga, J. M., Bansal, V., Fareed, J. (2009). Structural and Functional Characterization of Low-molecular-weight Heparins: Impact on the Development of Guidelines for Generic Products. Clinical and Applied Thrombosis/Hemostasis, 15 (2), 137–144. doi: https://doi.org/10.1177/1076029609332727
- Arnold, K., Capuzzi, S., Xu, Y., Muratov, E., Carrick, K., Szajek, A. et al. (2017). Modernization of Enoxaparin Molecular Weight Determination Using Homogeneous Standards. Pharmaceuticals, 10 (3), 66. doi: https://doi.org/10.3390/ph10030066
- Wanisa, A. M., Qasem, A. A., Asma, O. E. (2020). Green chemistry: principles, applications, and disadvantages. Chemical Methodologies, 4 (4), 408–423. doi: https://doi.org/10.33945/sami/chemm.2020.4.4
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2023 Yuliia Bovsunovska, Vitalii Rudiuk, Volodymyr Mishchenko, Victoriya Georgiyants

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.







