Дослідження факторів, що впливають на вивільнення in vitro декспантенолу із розчинів і м’яких лікарських засобів
DOI:
https://doi.org/10.15587/2519-4852.2023.279283Ключові слова:
декспантенол (DР), рідина, гель, крем, тест на вивільнення in vitro (IVRT)Анотація
Мета. Визначити фактори, що впливають на вивільнення in vitro декспантенолу (DР) з розчинів та м’яких лікарських засобів.
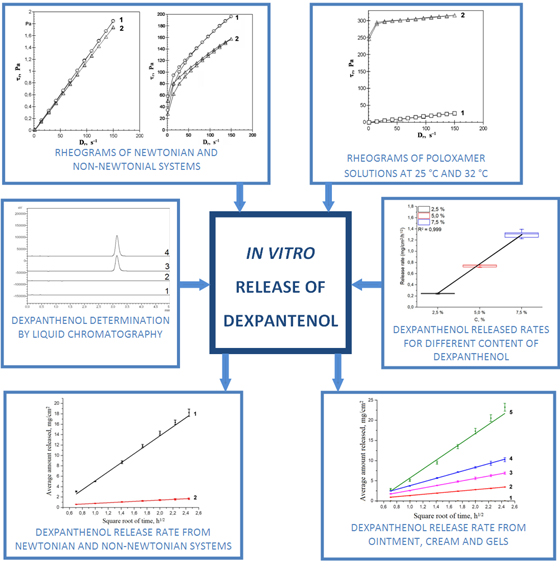
Матеріали та методи. Досліджували дисперсні системи, що містять 5.0 % DР: розчини, що є ньютонівськими рідинами, та м’які лікарські засоби (креми, гелі і мазь) з неньютонівськими типами плинності. Реологічні дослідження проводили методом ротаційної віскозиметрії. Випробування з вивільнення in vitro проводили з використанням вертикальних дифузійних камер. Вміст DР в діалізаті визначали методом рідинної хроматографії.
Результати. Показано, що найбільші значення параметрів вивільнення DР характерні для водного розчину; вони знижуються у присутності пропіленгліколю (PG), макроголу 400 (М400) та полоксамеру 338 (P338), але залишаються на досить високому рівні. Включення до складу ньютонівської рідини катіонної ПАР та цетостеарилового спирту (CSA) (0.5 : 4.5 % м/м) приводить до утворення дисперсних систем з пластичним типом плинності та до суттєвого уповільнення вивільнення DР. У разі крему, що містить неіонну ПАР і CSA, параметри вивільнення DР також знаходяться на низькому рівні. Мінімальним є вивільнення DР з мазі на основі емульсії в/м. Порівняно з водним розчином швидкість вивільнення DР з гелю на основі карбомеру зменшується в 2,8 разів; при додаванні 20 % суміші PG i M400 (10 : 10 % м/м) до складу такого гелю швидкість вивільнення DР зменшується ще в 1.5 рази. Найбільш швидко та повно DР вивільняється з дисперсної системи на основі Р338, що при температурі 32 оС перетворюється з ньютонівської рідини на гель.
Висновки. Вивільнення DР в дослідах in vitro залежить від типу основи; швидке і повне вивільнення DР характерне для його водного розчину, а мінімальне – для мазі на гідрофобній основі. Використання CSA у комбінації з ПАР або карбомеру для створення основ для м’яких лікарських засобів з пластичним типом течії є значущим фактором, що суттєво уповільнює вивільнення з них DР. Найбільші значення параметрів вивільнення DР спостерігались у разі гелю на основі Р338
Посилання
- The European Pharmacopoeia, 11th Edition (2022). EDQM. Strasbourg: Council of Europe. Available at: http://pheur.edqm.eu/subhome/11-0
- Proksch, E., de Bony, R., Trapp, S., Boudon, S. (2017). Topical use of dexpanthenol: a 70th anniversary article. Journal of Dermatological Treatment, 28 (8), 766–773. doi: https://doi.org/10.1080/09546634.2017.1325310
- Buckingham, R. (Ed.) (2020). Martindale: The Complete Drug Reference. London: Pharmaceutical Press, 4912.
- Gorski, J., Proksch, E., Baron, J. M., Schmid, D., Zhang, L. (2020). Dexpanthenol in Wound Healing after Medical and Cosmetic Interventions (Postprocedure Wound Healing). Pharmaceuticals, 13 (7), 138. doi: https://doi.org/10.3390/ph13070138
- Cho, Y. S., Kim, H. O., Woo, S. M., Lee, D. H. (2022). Use of Dexpanthenol for Atopic Dermatitis – Benefits and Recommendations Based on Current Evidence. Journal of Clinical Medicine, 11 (14), 3943. doi: https://doi.org/10.3390/jcm11143943
- Klunk, C., Domingues, E., Wiss, K. (2014). An update on diaper dermatitis. Clinics in Dermatology, 32 (4), 477–487. doi: https://doi.org/10.1016/j.clindermatol.2014.02.003
- Oguz, A., Uslukaya, O., Alabalık, U., Turkoglu, A., Kapan, M., Bozdag, Z. (2015). Topical N-Acetylcysteine Improves Wound Healing Comparable to Dexpanthenol: An Experimental Study. International Surgery, 100 (4), 656–661. doi: https://doi.org/10.9738/intsurg-d-14-00227.1
- Laffleur, F., Pschick, S., Barthelmes, J., Hauptstein, S., Bernkop-Schnurch, A. (2018). Impact of Surfactants on Skin Penetration of Dexpanthenol. Current Drug Delivery, 15 (3), 351–356. doi: https://doi.org/10.2174/1567201814666170503142707
- Sipos, E., Szász, N., Vancea, S., Ciurba, A. (2015). Evaluation and Selection of Gel Base for the Formulation of Dexpanthenol Products. Tropical Journal of Pharmaceutical Research, 13 (12), 1987–1992. doi: https://doi.org/10.4314/tjpr.v13i12.5
- Ilić, T., Pantelić, I., Savić, S. (2021). The Implications of Regulatory Framework for Topical Semisolid Drug Products: From Critical Quality and Performance Attributes towards Establishing Bioequivalence. Pharmaceutics, 13 (5), 710. doi: https://doi.org/10.3390/pharmaceutics13050710
- Tiffner, K. I., Kanfer, I., Augustin, T., Raml, R., Raney, S. G., Sinner, F. (2018). A comprehensive approach to qualify and validate the essential parameters of an in vitro release test (IVRT) method for acyclovir cream, 5%. International Journal of Pharmaceutics, 535 (1-2), 217–227. doi: https://doi.org/10.1016/j.ijpharm.2017.09.049
- The United States Pharmacopoeia, 41 – NF 36 (2018). The United States Pharmacopoeial Convention. Rockville. Available at: https://www.worldcat.org/title/united-states-pharmacopeia-2018-usp-41-the-national-formulary-nf-36/oclc/1013752699
- Draft guideline on quality and equivalence of topical products (2018). CHMP/QWP/708282/2018. Available at: www.ema.europa.eu/en/quality-equivalence-topical-products
- Bezuglaya, E., Ivashchenko, H., Lyapunov, N., Zinchenko, I., Liapunova, A., Stolper, Y. et al. (2021). Study of factors affecting the in vitro release of diclofenac sodium from hypromelose-based gels. ScienceRise: Pharmaceutical Science, 5 (33), 12–31. doi: https://doi.org/10.15587/2519-4852.2021.243040
- Alkilani, A., McCrudden, M. T., Donnelly, R. (2015). Transdermal Drug Delivery: Innovative Pharmaceutical Developments Based on Disruption of the Barrier Properties of the Stratum Corneum. Pharmaceutics, 7 (4), 438–470. doi: https://doi.org/10.3390/pharmaceutics7040438
- Sheskey, P. J., Hancock, B. C., Moss, G. P., Goldfarb, D. J. (Eds.) (2020). Handbook of Pharmaceutical Excipients. London: Pharm. Press, 1296.
- Nonsterile Semisolid Dosage Forms Scale-Up and Postapproval Changes: Chemistry, Manufacturing, and Controls. Release Testing and In Vivo Bioequivalence Documentation (1997). Guidance for Industry. U.S. Department of Health and Human Services; Food and Drug Administration Center for Drug Evaluation and Research (CDER), 37.
- Derzhavna Farmakopeіa Ukraini. Vol. 1 (2015). Kharkiv: Derzhavne pidpryiemstvo «Ukrayinskyi naukovyi farmakopeinyi tsentr yakosti likarskikh zasobiv», 1128.
- Derzhavniy reestr likarskih zasobiv Ukrayini. Available at: http://www.drlz.kiev.ua/
- Carbopol® Ultrez 21 Polymer. Technical Data Sheet (TDS-297) (2002). Cleveland: Lubrizol, 4.
- Derzhavna Farmakopeіa Ukraini. Dopovnennia 4 (2020). Kharkiv: Derzhavne pidpryiemstvo «Ukrayinskyi naukovyi farmakopeinyi tsentr yakosti likarskikh zasobiv», 600.
- Lyapunov, N., Bezuglaya, E., Liapunova, A., Zinchenko, I., Liapunov, O., Lysokobylka, O., Stolper, Y. (2022). Effect of the composition of emulsifiers and the dispersion medium on the properties of bases for semi-solid preparations. ScienceRise: Pharmaceutical Science, 5 (39), 29–45. doi: https://doi.org/10.15587/2519-4852.2022.266001
- Liapunov, N. A., Ivanov, L. V., Bezuglaya, E. P., Zhdanov, R. I., Tsimbal, L. V. (1992). A study of aggregates of surface-active substances (SAS) using the spin probe method. Pharmaceutical Journal, 5-6, 40–45.
- Bezuglaya, E., Lyapunov, N., Chebanov, V., Liapunov, O. (2022). Study of the formation of micelles and their structure by the spin probe method. ScienceRise: Pharmaceutical Science, 4 (38), 4–18. doi: https://doi.org/10.15587/2519-4852.2022.263054
- Pleguezuelos-Villa, M., Merino-Sanjuán, M., Hernández, M. J., Nácher, A., Peris, D., Hidalgo, I. et al. (2019). Relationship between rheological properties, in vitro release and in vivo equivalency of topical formulations of diclofenac. International Journal of Pharmaceutics, 572, 118755. doi: https://doi.org/10.1016/j.ijpharm.2019.118755
- Raghavan, L., Brown, M., Michniak-Kohn, B., Sammeta, S.; Langley, N., Michniak-Kohn, B., Osborne, D. W. (Eds.) (2019). Quality Assesment of API in Topical Drug Products. The Role of Microstructure in Topical Drug Product Development. Vol. 36. Springer: Cham, 47–87.
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2023 Elena Bezuglaya, Anna Liapunova, Igor Zinchenko, Nikolay Lyapunov

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.







