Розробка та валідація методики одночасного визначення кількісного вмісту альбендазолу та празиквантелу в таблетках, вкритих оболонкою «АП-гельмін»
DOI:
https://doi.org/10.15587/2519-4852.2024.290350Ключові слова:
валідація, рідинна хроматографія, кількісний аналіз, альбендазол, празиквантел, таблетки, вкриті оболонкоюАнотація
Адаптація сучасних методів кількісного аналізу діючих речовин за їх сумісним вмістом у лікарській формі, а також їх валідація є невід’ємним процесом фармацевтичної розробки. Нами розроблено препарат у формі таблеток, вкритих оболонкою, для лікування гельмінтозів травної системи у дорослих. Особливістю цього препарату є поєднання АФІ альбендазолу та празиквантелу у співвідношенні 1:4.
Метою даного дослідження є розробка методології кількісного аналізу обох речовин одночасно методом рідинної хроматографії, визначення їх можливого взаємного впливу на процес, а також валідація запропонованих методів.
Матеріали та методи. Для досягнення поставленої мети дослідження були визначені наступні завдання дослідження: вибір найбільш раціонального методу кількісного визначення альбендазолу та празиквантелу; підтвердження відсутності взаємного впливу АФІ на отримані результати; валідація обраних методів аналізу альбендазолу та празиквантелу.
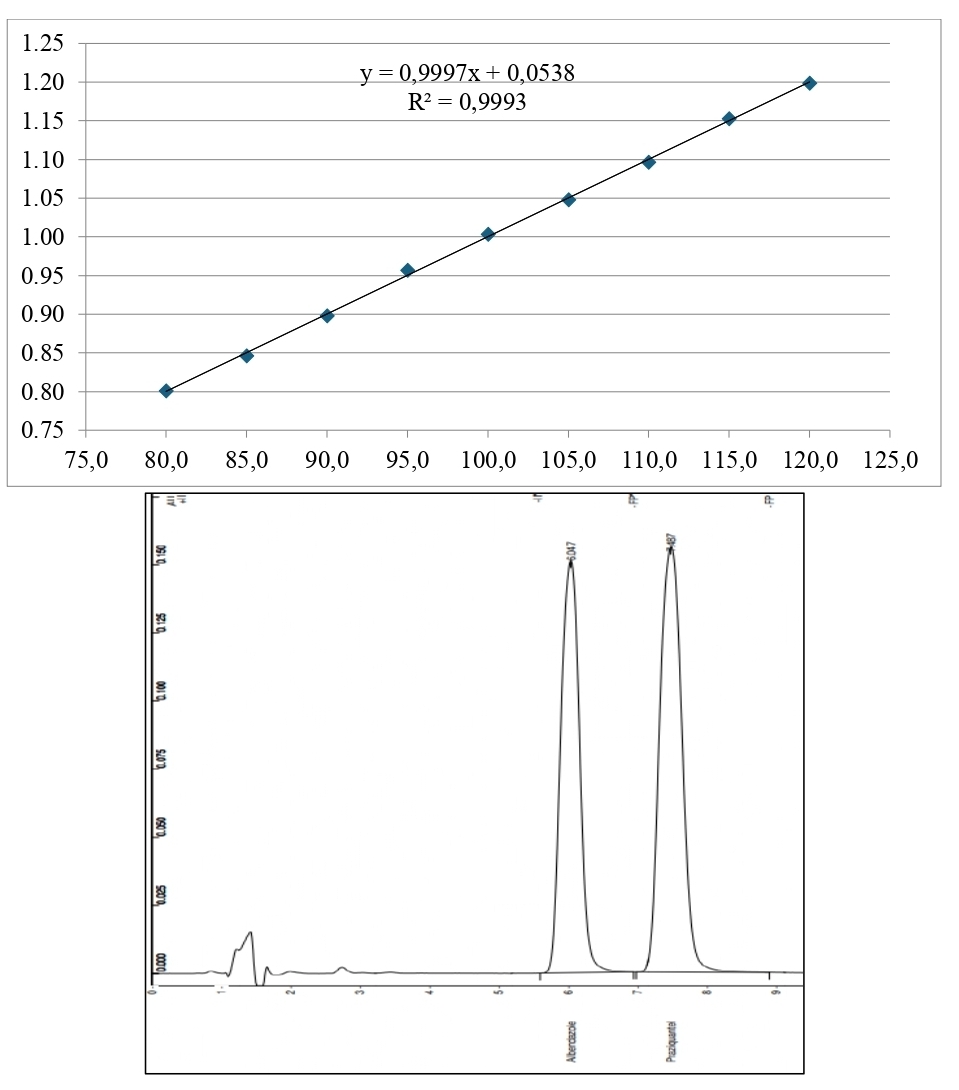
Об’єктом дослідження були таблетки, вкриті оболонкою «АП-гельмін», серії 1-5.2021; Фармакопейний стандартний зразок (PSS) альбендазолу та PSS празиквантел. Кількісне визначення альбендазолу та празиквантелу проводили за ДФУ, метод 2.2.29.
Результати. У статті описано умови та етапи кількісного визначення альбендазолу та празиквантелу. Описано основні показники валідації методики.
Висновки. Доведено, що кількісне визначення методом рідинної хроматографії обох субстанцій одночасно є валідованим, і субстанції не впливають на аналіз одна одної в таблетках, вкритих оболонкою «АП-гельмін» згідно з проектом МКЯ. Усі розраховані параметри відповідають необхідним критеріям перевірки
Посилання
- Semchenko, K., Vyshnevska, L., Polovko, N. (2018). Study of anthelmintic activity and acute toxicity of medicine of combined composition. ScienceRise: Pharmaceutical Science, 6 (16), 8–12. https://doi.org/10.15587/2519-4852.2018.151428
- Semchenko, K., Vyshnevska, L. (2020). Study of the specific activity of anthelmintic drug “Ap-helmin.” Ukrainian Biopharmaceutical Journal, 2 (63), 54–57. https://doi.org/10.24959/ubphj.20.271
- Semchenko, K. V., Vyshnevska, L. I. (2019). Pat. No. 124898 UA. Antyhelmintnyi zasib na osnovi albendazolu ta prazykvantelu. MPK: A61K 31/4184, A61K 31/47, A61P 33/00. No. a201910236; declareted: 07.10.2019, published: 08.12.2021, Bul. No. 49.
- European Pharmacopoeia (2021). Strasbourg: European Directorate for the Quality of Medicines & Health Care. Available at: https://pheur.edqm.eu/subhome/10-8
- State Pharmacopoeia of Ukraine. Vol. 1 (2015). Kharkiv: State Enterprise Ukrainian scientific pharmacopoeial centre of quality of drugs, 1128.
- Anil, W., Subhash, G., Roshan, I., Badri, P. N. (2008). Validated liquid chromatographic method for simultaneous estimation of albendazole and ivermectin in tablet dosage form. Indian Journal of Chemical Technology, 15, 617–620.
- Khanji, M., Kawas, G., Haroun, M., Rasheed, M. A., Sakur, A. A. (2020). Quantitative determination of albendazole forced degradation percentages by densitometric thin layer chromatographic method. Research Journal of Pharmacy and Technology, 13 (5), 2207–2213. https://doi.org/10.5958/0974-360x.2020.00396.0
- Kumari, N., Singh, B. (2019). Quality By Design: A systematic approach for the development of analytical method validation. Journal of Drug Delivery and Therapeutics, 9, 1006–1012.
- Fregonezi-Nery, M. M., Baracat, M. M., Kedor-Hackmann, É. R. M., Pinheiro, R. M. (2001). Determination of albendazole in oral suspension. Analytical Letters, 34 (8), 1255–1263. https://doi.org/10.1081/al-100104151
- Swamy, N., Basavaiah, K. (2014). Simple and rapid spectrophotometric assay of albendazole in pharmaceuticals using iodine and picric acid as CT complexing agents. Brazilian Journal of Pharmaceutical Sciences, 50 (4), 839–850. https://doi.org/10.1590/s1984-82502014000400019
- Refat, M. S., Mohamed, G. G., Fathi, A. (2011). Spectrophotometric Determination of Albendazole Drug in Tablets: Spectroscopic Characterization of the Charge‐transfer Solid Complexes. Chinese Journal of Chemistry, 29 (2), 324–332. https://doi.org/10.1002/cjoc.201190086
- Tella, A. C., Olabemiwo, O. M., Malwi, M. O., Obiyenwal, G. K. (2010). Developing a spectrophotometric method for the estimation of albendazole in solid and suspension forms. International Journal of Physical Sciences, 5, 379–382.
- Ahmed, D. A., Abdel-Aziz, O., Abdel-Ghany, M., Weshahy, S. A. (2018). Stability indicating determination of Albendazole in bulk drug and pharmaceutical dosage form by chromatographic and spectrophotometric methods. Future Journal of Pharmaceutical Sciences, 4 (2), 161–165. https://doi.org/10.1016/j.fjps.2018.02.001
- Ferencz, E., Kelemen, É.-K., Obreja, M., Sipos, E., Vida, S., Urkon, M., Szabó, Z.-I. (2021). Computer-assisted UHPLC method development and optimization for the determination of albendazole and its related substances. Journal of Pharmaceutical and Biomedical Analysis, 203, 114203. https://doi.org/10.1016/j.jpba.2021.114203
- Saini, G., Singh, B., Vyas, M., Durgapal, S., Rangra, N., Suttee, A. (2024). RP-HPLC method development and validation of Albendazole and its impurity. BIO Web of Conferences, 86, 01046. https://doi.org/10.1051/bioconf/20248601046
- Rashed, N. S., Zayed, S., Abdelazeem, A., Fouad, F. (2020). Development and validation of a green HPLC method for the analysis of clorsulon, albendazole, triclabendazole and ivermectin using monolithic column: Assessment of the greenness of the proposed method. Microchemical Journal, 157, 105069. https://doi.org/10.1016/j.microc.2020.105069
- Varghese, S., Vasanthi, P., Ravi, T. (2011). Simultaneous densitometric determination of ivermectin and albendazole by high-performance thin-layer chromatography. Journal of Planar Chromatography – Modern TLC, 24 (4), 344–347. https://doi.org/10.1556/jpc.24.2011.4.13
- Saleh, H., Schnekenburger, J. (1992). Determination of praziquantel and of praziquantel in tablets by gas–liquid chromatography. The Analyst, 117 (9), 1457–1460. https://doi.org/10.1039/an9921701457
- Mainardes, R. M., Cinto, P. O., Gremião, M. P. D. (2006). High-performance Liquid Chromatography Determination of Praziquantel in Tablets and Raw Materials. Acta Farmacutica Bonaerense, 25 (4), 567–570.
- Soto, C., Contreras, D., Orellana, S., Yañez, J., Toral, M. I. (2010). Simultaneous Determination of Albendazole and Praziquantel by Second Derivative Spectrophotometry and Multivariated Calibration Methods in Veterinary Pharmaceutical Formulation. Analytical Sciences, 26 (8), 891–896. https://doi.org/10.2116/analsci.26.891
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Kateryna Semchenko, Liliia Vyshnevska, Volodymyr Iakovenko, Tetyana Kovalova, Mykhailo Marchenko, Yelizaveta Zuikina, Yana Marchenko

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.







