Визначення хроматографічних умов для кількісної оцінки активних компонентів у спрею назальному складному при випуску та протягом терміну придатності
DOI:
https://doi.org/10.15587/2519-4852.2024.299184Ключові слова:
спрей, фенілефрину гідрохлорид, лідокаїну гідрохлорид, полівінілпіролідон, пантенол, нітрофурал, дифенгідраміну гідрохлорид, кількісне визначення, рідинна хроматографія, стабільністьАнотація
Метою роботи є розробка хроматографічних умов, вивчення валідаційних характеристик методики кількісного визначення фенілефрину гідрохлориду, нітрофуралу, лідокаїну гідрохлориду та дифенгідраміну гідрохлориду, пантенолу, повідону у спільній присутності в спрею назальному складному методом рідинної хроматографії з УФ-детектуванням. Оцінка кількісного вмісту активних компонентів при випуску та протягом терміну придатності.
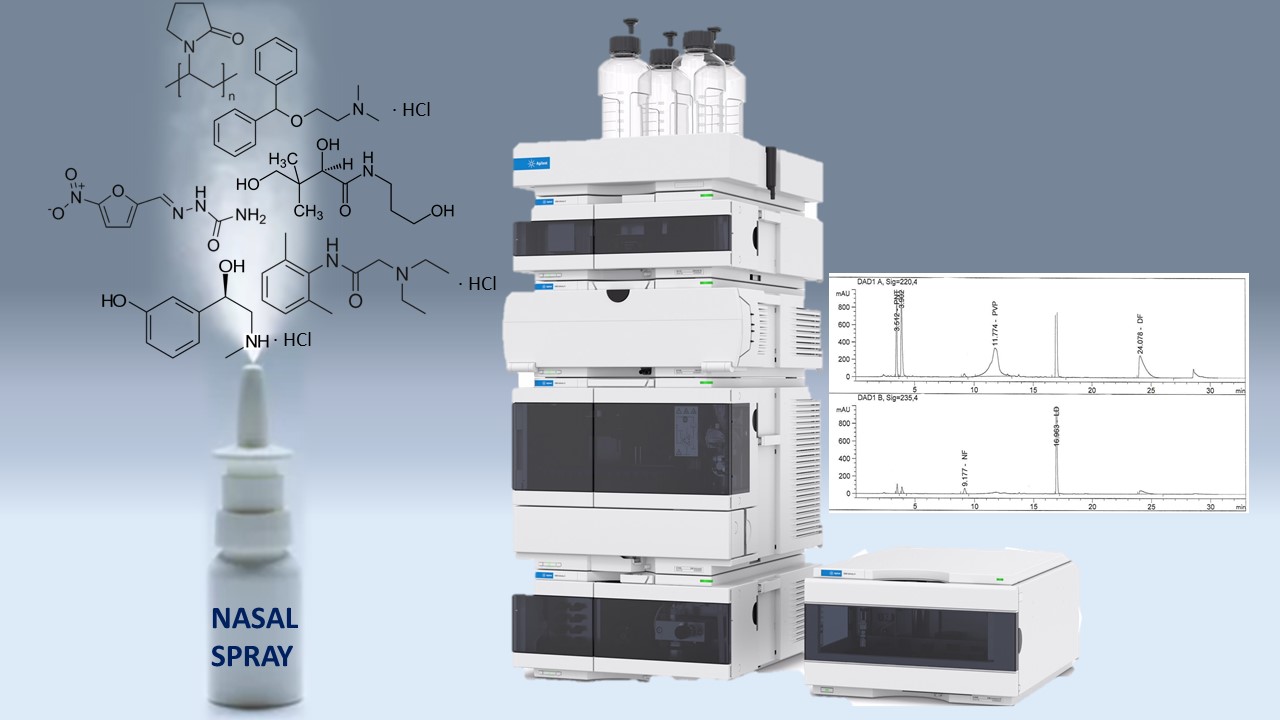
Матеріали і методи. Рідинні хроматографи Agilent 1260, обладнані діодно-матричним детектором фірми «Agilent technologies», США. Колонки хроматографічні розміром 250×4,6 мм, що заповнені силікагелем октадецилсилільним для хроматографії (Zorbax StableBond SB-Aq, фірми «Agilent»), рухома фаза А – фосфатний буферний розчин рН 7,0 – ацетонітрил Р (1650:350), рухома фаза В – ацетонітрил Р; режим елюювання – градієнтний; швидкість потоку рухомої фази – 1,0 мл/хв; довжини хвиль детектування – 220 нм (для пантенолу, фенілефрину, повідону, дифенгідраміну) та 235 нм (для нітрофуралу та лідокаїну).
Результати. Умови хроматографічного розділення були розроблені для визначення за спільної присутності для шести цільових речовин: пантенолу, фенілефрину гідрохлориду, нітрофуралу, повідону, лідокаїну гідрохлориду та дифенгідраміну гідрохлориду. Придатність методики для виконання цієї задачі підтверджували визначенням валідаційних характеристик. Методика на належному рівні характеризується специфічністю, лінійністю, правильністю та збіжністю в діапазоні застосування для пантенолу (діапазон 20,33-38,26 мг/мл, ΔZ=0.93 ≤ max ΔZ=3.20, a=0.63 max a=5.12, r = 0.9978 min r= 0.9924), фенілефрину гідрохлориду (діапазон 1,70-3,21 мг/мл, ΔZ=0.51 ≤ max ΔZ=3.20, a=0.15 max a=5.12, r = 0.9984 min r= 0.9924), нітрофуралу (діапазон 0.137-0.257 мг/мл, ΔZ=0.91 ≤ max ΔZ=3.20, a=0.032 max a=5.12, r = 0.9987 min r= 0.9924) повідону (діапазон 20,44-38,50 мг/мл, ΔZ=0.23 ≤ max ΔZ=3.20, a=2,33 max a=5.12, r = 0.9942 min r= 0.9924), лідокаїну гідрохлориду (діапазон 6,80-12,81 мг/мл, ΔZ=0.34 ≤ max ΔZ=3.20, a=0.66 max a=5.12, r = 0.9988 min r= 0.9924), дифенгідраміну гідрохлориду (діапазон 1,36-2,56 мг/мл, ΔZ=0.20 ≤ max ΔZ=3.20, a=0.15 max a=5.12, r = 0.9980 min r= 0.9924). Значні зміни відсутні при зберігання при 25 °С протягом 6 місяців.
Висновки. Розроблена аналітична методика кількісного визначення компонентного складу в екстемпоральному спрею назальному складному методом високоефективної рідинної хроматографії. Визначені валідаційні параметри підтверджують коректність методики. Хімічна стабільність лікарської формі спостерігається впродовж 6 місяців
Посилання
- Pro zatverdzhennia Unifikovanoho klinichnoho protokolu pervynnoi ta spetsializovanoi medychnoi dopomohy "Hostryi rynosynusyt" (2023). Nakaz MOZ Ukrainy No. 1793.13.10.2023. Available at: https://moz.gov.ua/article/ministry-mandates/nakaz-moz-ukraini-vid-13102023--1793-pro-zatverdzhennja-unifikovanogo-klinichnogo-protokolu-pervinnoi-ta-specializovanoi-medichnoi-dopomogi-gostrij-rinosinusit-unifikovanogo-klinichnogo-protokolu-pervinnoi-ta-specializovanoi-medichnoi
- Savchenko, L. P., Georgiyants, V. A. (2020). Current trends in compounding of medicines and its legislative regulation in foreign countries. Farmatsevtychnyi Zhurnal, 4 (75), 6–17. https://doi.org/10.32352/0367-3057.4.20.01
- Samborskyi, O. S. (2018). Investigation of the opportunities of manufacturing pharmacy in ukraine and abroad. Pharmaceutical Review, (1), 102–114. https://doi.org/10.11603/2312-0967.2018.1.8695
- Cherniakova, V., Bevz, N., Strilets, O., Harna, N., Bevz, O., Yevtifieieva, O. (2023). The study of the stability of silver proteinate solutions prepared in pharmacies. ScienceRise: Pharmaceutical Science, 5 (45), 24–31. https://doi.org/10.15587/2519-4852.2023.289798
- Al-Salman, H. N. K., Al-Jadaan Shaker, A. N., Alnuaim, M., Hussein, H. H. (2017). Estimation of Lidocaine-HCl in Pharmaceutical drugs by HPLC-UV System. American Journal of PharmTech Research, 7 (1), 369–378.
- Diphenhydramine hydrochloride oral solution, USP43. Available at: https://www.uspnf.com/ Last accessed: 27.05.2023
- Diphenhydramine hydrochloride. 01/2016:0023, Ph.Eur. 11.0 (2016). Available at: https://pheur.edqm.eu/home Last accessed: 27.05.2023
- Derzhavna Farmakopeia Ukrainy. Vol. 3. Kharkiv: Derzhavne pidpryiemstvo «Ukrainskyi naukovyi farmakopeinyi tsentr yakosti likarskykh zasobiv», 732.
- Phenylephrine hydrochloride, USP43. Available at: https://www.uspnf.com/ Last accessed: 21.05.2023
- Nitrofural, 01/2022:1135, Ph.Eur., 11.0. Available at: https://pheur.edqm.eu/home Last accessed: 27.05.2023
- Mahboubi, A., Gholamreza Alviri, M., Afshar, M., Farhangi, M. (2019). Development and Validation of A Fast, Simple And Specific Stability Indicating RP-HPLC Method for Determination of Dexpanthenol in Eye Gel Formulation. Iranian Journal of Pharmaceutical Research, 18 (2), 670–676. https://doi.org/10.22037/ijpr.2019.1100681
- Weiss, C. L., Fairchild, M. R., Stanton, B., Nshime, B. S., Parkanzky, P. D. (2019). Innovative Method for the Analysis of Dexpanthenol in Hair Care Products. Journal of AOAC INTERNATIONAL, 102 (2), 633–637. https://doi.org/10.5740/jaoacint.18-0053
- Povidone, USP43-NF38, 3631. Available at: https://www.uspnf.com/ Last accessed: 05.06.2023
- Povidone, 04/2024:0685, Ph.Eur., 11.4. Available at: https://pheur.edqm.eu/home Last accessed: 27.08.2023
- Kirkpatrick, D., Fain, M., Yang, J., Santos, L., Anthony, C. (2019). UHPLC assay and impurity methods for diphenhydramine and phenylephrine hydrochloride oral solution. SEPARATION SCIENCE PLUS, 3 (1-2), 4–11. https://doi.org/10.1002/sscp.201900084
- Palur, K., Archakam, S. C., Koganti, B. (2020). Chemometric assisted UV spectrophotometric and RP-HPLC methods for simultaneous determination of paracetamol, diphenhydramine, caffeine and phenylephrine in tablet dosage form. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 243, 118801. https://doi.org/10.1016/j.saa.2020.118801
- Cherniakova, V., Myhal, A., Rudiuk, V., Studenyak, Y., Kryvanych, O., Bevz, N., Georgiyants, V. (2023). Design and validation of analytical methods for quantitative determination of active ingredients in extemporal combined medicine in spray form. ScienceRise: Pharmaceutical Science, 6 (46), 31–40. https://doi.org/10.15587/2519-4852.2023.294919
- KNOWLEDGE Database. Available at: https://www.edqm.eu/en/knowledge-database Last accessed: 27.05.2023
- Derzhavna farmakopeia Ukrainy. Dopovnennia 4 (2.4) (2020). Kharkiv: Derzhavne pidpryiemstvo «Ukrainskyi naukovyi farmakopeinyi tsentr yakosti likarskykh zasobiv», 600.
- Derzhavna Farmakopeia Ukrainy. Vol. 1. Kharkiv: Derzhavne pidpryiemstvo «Ukrainskyi naukovyi farmakopeinyi tsentr yakosti likarskykh zasobiv», 1028.
- ICH guideline Q2(R2) on validation of analytical procedures Step 2b (2022). European Medicines Agency, 39.
- Yevtifieieva, O. A., Georgiyants, V. A. (2021). Medicines manufactured in pharmacies: features of validation of analytical methods and tests (Prior to the introduction of the monograph section of the SPU). Farmatsevtychnyi Zhurnal, 6, 80–93. https://doi.org/10.32352/0367-3057.6.21.08
- ICH Q1A (R2) Stability testing of new drug substances and drug products Step 5 (2003). European Medicines Agency, 20.
- ST-N MOZU 42-3.3:2004 Likarski zasoby. Nastanova z yakosti. Vyprobuvannia stabilnosti (2012). Kyiv: Ministerstvo okhorony zdorovia Ukrainy. Available at: https://compendium.com.ua/uk/clinical-guidelines-uk/standartizatsiya-farmatsevtichnoyi-produktsiyi-tom-1/st-n-mozu-42-3-3-2004/
- Lidocaine, USP43-NF38, 2620. Available at: https://www.uspnf.com/ Last accessed: 05.06.2023
- Lidocaine hydrochloride monohydrate, 01/2019:0227, Ph.Eur., 11.4. Available at: https://pheur.edqm.eu/home Last accessed: 27.07.2023
- Lidocaine hydrochloride, USP43-NF38, 2623. Available at: https://www.uspnf.com/ Last accessed: 05.06.2023)
- <115> Dexpanthenol assay, USP43-NF38, 6547. Available at: https://www.uspnf.com/ Last accessed: 05.06.2023
- Dexpanthenol, 04/2023:0761, Ph.Eur., 11.4 Available at: https://pheur.edqm.eu/home Last accessed: 27.07.2023
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Valeriia Cherniakova, Artem Myhal, Vitalii Rudiuk, Oleksandr Kryvanych, Olha Rudakova, Igor Tugaibei, Nataliia Bevz, Victoriya Georgiyants

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.








