Застосування підходу зведення бюджету варіювання для теста Розчинення
DOI:
https://doi.org/10.15587/2519-4852.2024.299217Ключові слова:
AQbD, цільова невизначеність, джерело варіювання, незначущість, нормальна аналітична практика, розчинення, точка нескінченності, однорідність дозованих одиниць, таблетки метформіну, бюджет варіюванняАнотація
Мета. Дослідження мало на меті оцінити повноту наших знань про джерела варіювання у тесті Розчинення зі 100 % вивільненням, шляхом складання бюджету варіювання.
Матеріали та методи. Дослідження проводили на таблетках метформіну 500 мг з використанням реактивів фармакопейної якості, стандартного зразка Державної Фармакопеї України (ДФУ) Метформіну гідрохлорид, апарату для розчинення Pharmatest DT70, спектрофотометра Perkin Elmer Lambda 35, аналітичних ваг Mettler Toledo XP 204, мірного посуду ISO класу А. Використовувався метрологічний підхід ДФУ.
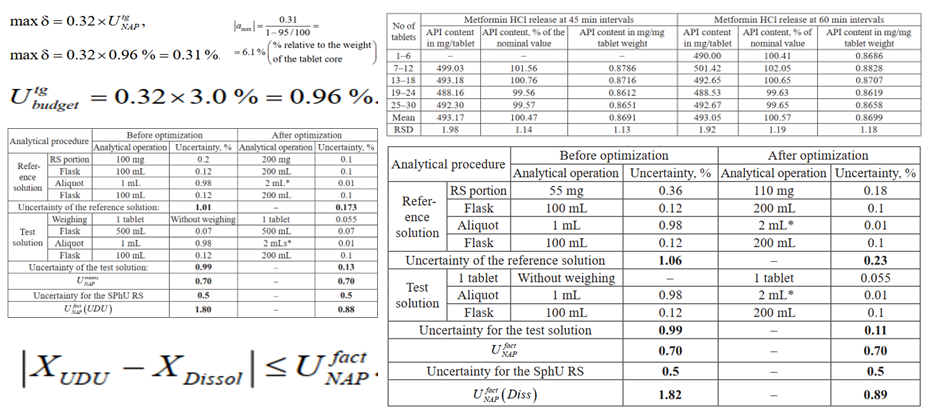
Результати і обговорення. Бюджет варіювання був складений на основі порівняння оцінок невизначеності, отриманих на основі вимог до максимально допустимого варіювання для нормальної аналітичної практики (UNAP, оцінювання bottom-up) та експериментальних даних (Uexp). Це передбачало визначення вмісту метформіну в таблетках за допомогою тесту Однорідність Дозованих Одиниць (ОДО) як незалежного методу. 100 % вивільнення метформіну в тесті Розчинення (точка нескінченності) було підтверджено збільшенням часу розчинення. Оптимізувавши аналітичні процедури Розчинення та ОДО для складання бюджету варіювання, ми досягли незначущості Uexp порівняно з цільовою невизначеністю для тесту Розчинення під час тестування на відповідність специфікаціям(Utg). Відмінності середніх результатів ОДО та Розчинення не перевищували UNAP для часу вивільнення 45 та 60 хвилин, тобто бюджет невизначеності був доведений. Uexp для тесту Розчинення вказує на наявність невідомого статистично значущого джерела випадкового варіювання, яке, однак, було менше за Utg; отже, методика підходить для тестування на відповідність специфікаціям.
Висновок. Експериментальні результати підтвердили повноту наших знань про джерела варіювання (відсутність зміщення) для тесту Розчинення зі 100 % вивільненням. Неодмінною умовою складання бюджету була оптимізація невизначеності аналітичних методик. Для ОДО всі значущі джерела варіювання були в межах очікуваного діапазону. Проте існує потреба в додаткових дослідженнях для ідентифікації та управління невідомим джерелом практично значних випадкових варіацій для тесту Розчинення
Посилання
- Decision rules applied to conformity assessment (2017). Eurolab Technical Report Available at: https://eurolab-d.de/files/eurolab_technical_report_no.1-decision_rules_applied_to_conformity_assessment-2017_final.pdf
- Borman, P., Campa, C., Delpierre, G., Hook, E., Jackson, P., Kelley, W. et al. (2021). Selection of Analytical Technology and Development of Analytical Procedures Using the Analytical Target Profile. Analytical Chemistry, 94 (2), 559–570. https://doi.org/10.1021/acs.analchem.1c03854
- Martin, G., Barnett, K. et. al. (2013). Lifecycle Management of Analytical Procedures: Method Development, Procedure Performance Qualification, and Procedure Performance Verification. Pharmacopeial Forum, 39 (5). Available at: http://www.usppf.com/pf/pub/index.html.
- Weitzel, J., Meija, J., LeBlond, D., Walfish, S. (2018). Measurement uncertainty for the pharmaceutical industry. Pharmacopeial Forum, 44 (1). Available at: https://www.researchgate.net/publication/322370632_Measurement_Uncertainty_for_the_Pharmaceutical_Industry
- Martin, G., Barnett, K., Burgess, C., Curry, P. D., Ermer, J., Gratzl, G. S. et al. (2017). Proposed New USP General Chapter: The Analytical Procedure Lifecycle <1220>. Pharmacopeial Forum, 43 (1). Available at: https://www.researchgate.net/publication/312062483_Proposed_new_USP_general_chapter_The_analytical_procedure_lifecycle_1220
- Burgess, C., Curry, P. LeBlond, D. J., Gratzl, G. S., Kovacs, E., Martin, G. P. et al. (2016). Fitnes for use: Decision rules and target measurement uncertainty. Pharmacopeial Forum, 42 (2). Available at: https://www.researchgate.net/publication/298822306_Fitness_for_use_Decision_rules_and_target_measurement_uncertainty
- Kovacs, E., Ermer, J., McGregor, P. L., Nethercote, P., Lobrutto, R., Martin, G. P. et al. (2016). Analytical control strategy. Pharmacopeial forum, 42 (5). Available at: https://www.researchgate.net/publication/308478035_Analytical_control_strategy
- Technical Review of MHRA Analytical Quality by Design Project (2019). Medicines and Healthcare products Regulatory Agency. Available at: https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/807416/AQbD_Technical_Document_-_Final_04_June_2019.pdf
- Barnet, K., McGregor, P. et al. (2017). Analytical target profile: Structure and application throughout the analytical lifecycle. Pharmacopeial forum, 42 (5).
- Derzhavna Farmakopeia Ukrainy. Dopovnennia 2 (2018). 5.3.N.1. Statystychnyi analiz rezultativ khimichnoho eksperymentu. Kharkiv: Derzhavne pidpryiemstvo «Ukrainskyi naukovyi farmakopeinyi tsentr yakosti likarskykh zasobiv», 77–112.
- Derzhavna Farmakopeia Ukrainy. Dopovnennia 4 (2020). 5.3.N.2. Validatsiia analitychnykh metodyk i vyprobuvan. Kharkiv: Derzhavne pidpryiemstvo "Ukrainskyi naukovyi farmakopeinyi tsentr yakosti likarskykh zasobiv", 123–236.
- Leontiev, D., Petrus, V., Gryzodub, O., Volovyk, N. (2018). Assay and uniformity of dosage units: non-uniformity effects and quality assurance. Farmakom, 2, 45–55. Available at: http://sphu.org/wp-content/uploads/2018/07/Farmacom_2_2018_correction.pdf
- Volovyk, N., Leontiev, D., Petrus, V., Gryzodub, O., Pidpruzhnykov, Y. (2020). Development of an advanced strategy on the assay method transfer. ScienceRise: Pharmaceutical Science, 6 (28), 56–67. https://doi.org/10.15587/2519-4852.2020.221721
- Leontiev, D., Petrus, V., Volovyk, N., Gryzodub, O. (2020). Validation of the spectrophotometric procedure for desloratadine assay in tablets applying the uncertainty concept of the State Pharmacopoeia of Ukraine. EUREKA: Health Sciences, 6, 74–87. https://doi.org/10.21303/2504-5679.2020.001527
- Leontiev, D., Petrus, V., Volovyk, N., Gryzodub, O. (2020). A study of the influence of the test sample inhomogeneity on variability in assay results of desloratadine in film-coated tablets. ScienceRise: Pharmaceutical Science, 5 (27), 43–51. https://doi.org/10.15587/2519-4852.2020.215287
- European Pharmacopoeia 11th edition. Vol. 1 (2023). Dissolution test for solid dosage forms 2.9.3. Strasbourg: European Directorate for the Quality of Medicines, 1, 348–335.
- European Pharmacopoeia 11th edition. Vol. 1 (2023). Recommendations on dissolution testing 5.17.1. Strasbourg: European Directorate for the Quality of Medicines, 837–839.
- United States Pharmacopeia (2023). The Dissolution Procedure: Development and Validation <1092>. Currently Official on 19.09.2023. Available at: https://www.drugfuture.com/Pharmacopoeia/USP32/pub/data/v32270/usp32nf27s0_c1092.html
- Sano, A. Y., Lourenço, F. R. (2023). Measurement uncertainty arising from sampling and analytical steps of dissolution test of prednisone tablets. Journal of Pharmaceutical and Biomedical Analysis, 234. https://doi.org/10.1016/j.jpba.2023.115501
- Paakkunainen, M., Matero, S., Ketolainen, J., Lahtela-Kakkonen, M., Poso, A., Reinikainen, S.-P. (2009). Uncertainty in dissolution test of drug release. Chemometrics and Intelligent Laboratory Systems, 97 (1), 82–90. https://doi.org/10.1016/j.chemolab.2008.12.004
- Gryzodub, O., Leontiev, D., Levin, M., Asmolova, N., Vyrova, H. (2004). Realization of «Content uniformity» and «Dissolution» tests by chromatographic methods under production quality control. General experimental scheme. Journal of organic and pharmaceutical chemistry, 2 (1 (5)), 24–34.
- DeStefano, A. J., Hauck, W. W., Stippler, E. S., Brown, W. E., Li, C., Huang, G. G. et al. (2010). Establishing New Acceptance Limits for Dissolution Performance Verification of USPC Apparatus 1 and 2 Using USPC Prednisone Tablets Reference Standard. Pharmaceutical Research, 28 (3), 505–516. https://doi.org/10.1007/s11095-010-0295-3
- Bai, G., Armenante, P. M. (2009). Hydrodynamic, mass transfer, and dissolution effects induced by tablet location during dissolution testing. Journal of Pharmaceutical Sciences, 98 (4), 1511–1531. https://doi.org/10.1002/jps.21512
- Gryzodub, O., Arkhipova, N., Kozhushko, G., Zvolinskaya, N., Leontiev, D. (2003). Atestatsiia promyslovykh tabletok yak testovykh zrazkiv dlia profesiinoho testuvannia laboratorii z kontroliu yakosti likarskykh zasobiv: urakhuvannia faktoriv neodnoridnosti. Farmakom, 3, 5–19. Available at: http://sphu.org/en/journal-pharmacom
- Technical Guide for the Elaboration of Monographs (2022). European Directorate for the Quality of Medicines & HealthCare. Council of Europe. Strasbourg.
- European Pharmacopoeia 11th edition. Vol. 1 (2023). Absorption Spectrophotometry, ultraviolet and visible 2.2.25. Strasbourg: European Directorate for the Quality of Medicines, 48–52.
- General European OMCL Network (GEON). Quality management document PA/PH/OMCL (19)100 R1 (2020). Qualification of UV-visible spectrophotometers. Available at: https://www.edqm.eu/documents/52006/128968/omcl-annex-3-qualification-of-uv-visible-spectrophotometers.pdf/34fa3c33-7383-dedd-c1b6-c775130a1602?t=1628491783930
- The use of mechanical calibration of dissolution apparatus 1 and 2 – current good manufacturing practice (2010). FDA Guidance for industry. Available at: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/use-mechanical-calibration-dissolution-apparatus-1-and-2-current-good-manufacturing-practice-cgmp
- ASTM Standard practice for qualification of basket and paddle dissolution apparatus E20503-07. Edition 1 (2015). Available at: https://webstore.ansi.org/standards/astm/astme250307
- Leontiev, D., Volovyk, N., Gryzodub, O. (2021). Metrological aspects of the certification of reference standards of the State Pharmacopoeia of Ukraine. Trends & Challenges in Ensuring Quality in Analytical Measurements. Prague, 54–55. Available at: https://www.eurachem.org/images/stories/workshops/2021_05_QA/pdf/abstracts/Book_of_Abstracts_final.pdf
- European Pharmacopoeia 11th edition. Vol. 1 (2023). Uniformity of dosage units 2.9.40. Strasbourg: European Directorate for the Quality of Medicines, 421–423.
- Ellison, S., Williams, A. (Eds.) (2012). Eurachem/CITAC Guide: Quantifying uncertainty in analytical measurement. Available at: https://www.eurachem.org/images/stories/Guides/pdf/QUAM2012_P1.pdf
- European Pharmacopoeia 11th edition. Vol. 2 (2023). Monograph Metformin hydrochloride. Strasbourg: European Directorate for the Quality of Medicines, 3359–3360.
- Chapter Application of Analytical Quality by Design to Pharmacopoeial Methods (2022). The British Pharmacopoeia Supplementary. Public consultation. Available at: https://www.pharmacopoeia.com/file/AQbD_in_the_BP-Supplementary_Chapter.pdf
- Leontiev, D., Gryzodub, O., Arkhipova, N., Zvolynska, N., Dotsenko, T, Denysenko, N. (2003). Vidtvoriuvanist farmakopeinykh metodyk VERKh pry kilkisnomu vyznachenni likarskykh zasobiv u riznykh laboratoriiakh: rol nevyznachenosti probopidhotovky. Farmakom, 4, 4–12. Available at: http://sphu.org/en/journal-pharmacom
- Gryzodub, O., Zvolinskaya, N., Arkhipova, N., Leontiev, D., Denysenko, N., Dotsenko, T. (2004). Vosproizvodimost farmakopeynyih spektrofotometricheskih metodik kolichestvennogo opredeleniya lekarstvennyih sredstv v raznyih laboratoriyah. Farmakom, 2, 20–34.
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Dmytro Leontiev, Vitalii Asmolov, Natalia Volovyk, Oleksandr Gryzodub

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.







