Основа ксилометазоліну, придатна для використання у ліпофільних лікарських засобах: розробка технології одержання та аналітичних методів контролю якості
DOI:
https://doi.org/10.15587/2519-4852.2024.310656Ключові слова:
ксилометазолін, технологія, ефірні олії, стабільність, рідинна хроматографія, ліпофільність, хлориди, валідація, синтезАнотація
Мета: розробка технології одержання основи ксилометазоліну, придатної для розробки формуляцій в комбінації з ефірними оліями. Розробка та валідація методик контролю супровідних домішок та кількісного визначення одержаної основи ксилометазоліну. Дослідження стабільності отриманої основи ксилометазоліну за довгострокових та прискорених умов.
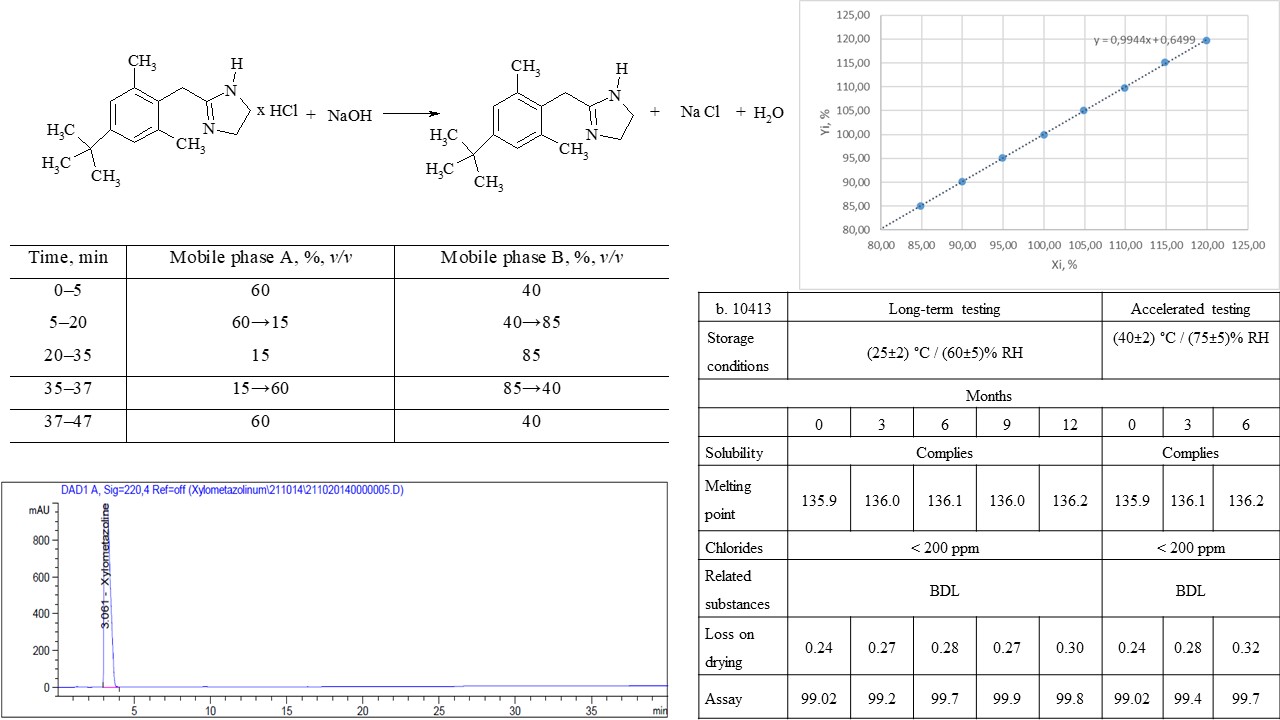
Матеріали та методи: Експериментальні зразки основи ксилометазоліну були отримані з комерційно доступного ксилометазоліну гідрохлориду та водного розчину гідроксиду натрію. Контроль якості одержаної субстанції проводили відповідно до вимог внутрішньої специфікації. Аналіз вихідної сировини ксилометазоліну гідрохлориду проводили відповідно до монографії Європейської Фармакопеї на Ксилометазоліну гідрохлорид (Ph. Eur. 10.1, 1162 (01/2008)).
Результати: було розроблено технологію одержання ксилометазоліну основи з ксилометазоліну гідрохлориду дією 2 % розчину сильної основи, а саме гідроксиду натрію. Розроблені та валідовані методики контролю якості одержаної основи ксилометазоліну за показниками супровідні домішки та кількісне визначення. Стабільність субстанції вивчено протягом 1 року; результати контролю за прискорених умов дослідження, відповідають вимогам специфікації, що дозволяє встановити термін придатності 2 роки.
Висновки: розроблена технологія отримання ксилометазоліну основи та методики контролю якості на основі монографії Європейської Фармакопеї на Ксилометазоліну гідрохлорид. Розроблена технологія забезпечує належну якість субстанції відповідно до вимог внутрішньої специфікації. Аналітичні методики «супровідні домішки» та «кількісне визначення» відповідають встановленим критеріям під час валідації. Отримані результати в подальшому використані для розробки препарату на основі ксилометазоліну та олії евкаліпту — Евказолін, краплі назальні
Посилання
- Haenisch, B., Walstab, J., Herberhold, S., Bootz, F., Tschaikin, M., Ramseger, R., Bönisch, H. (2010). Alpha‐adrenoceptor agonistic activity of oxymetazoline and xylometazoline. Fundamental & Clinical Pharmacology, 24 (6), 729–739. https://doi.org/10.1111/j.1472-8206.2009.00805.x
- Graf, C., Bernkop-Schnürch, A., Egyed, A., Koller, C., Prieschl-Grassauer, E., Morokutti-Kurz, M. (2018). Development of a nasal spray containing xylometazoline hydrochloride and iota-carrageenan for the symptomatic relief of nasal congestion caused by rhinitis and sinusitis. International Journal of General Medicine, 11, 275–283. https://doi.org/10.2147/ijgm.s167123
- Graf, P., Eccles, R., Chen, S. (2009). Efficacy and safety of intranasal xylometazoline and ipratropium in patients with common cold. Expert Opinion on Pharmacotherapy, 10 (5), 889–908. https://doi.org/10.1517/14656560902783051
- Kehrl, W., Sonnemann, U. (2000). Verbesserung der Wundheilung nach Nasenoperationen durch kombinierte Anwendung von Xylometazolin und Dexpanthenol. Laryngo-Rhino-Otologie, 79 (3), 151–154. https://doi.org/10.1055/s-2000-295
- EP1446119B1 (2006). Compositions comprising ipatropium and xylometazoline for treatment of the common cold. Published: 01.03.2006.
- Pat. CN1832726A (2009). Aqueous pharmaceutical solution containing oxymetazoline and/or xylometazoline. Published: 26.08.2009.
- Challier, C., Mártire, D. O., García, N. A., Criado, S. (2017). Visible light-mediated photodegradation of imidazoline drugs in the presence of Riboflavin: Possible undesired effects on imidazoline-based eye drops. Journal of Photochemistry and Photobiology A: Chemistry, 332, 399–405. https://doi.org/10.1016/j.jphotochem.2016.09.009
- Arnott, J. A., Planey, S. L. (2012). The influence of lipophilicity in drug discovery and design. Expert Opinion on Drug Discovery, 7 (10), 863–875. https://doi.org/10.1517/17460441.2012.714363
- Hinchcliffe, M., Illum, L. (1999). Intranasal insulin delivery and therapy. Advanced Drug Delivery Reviews, 35 (2-3), 199–234.
- Chouhan, S., Sharma, K., Guleria, S. (2017). Antimicrobial Activity of Some Essential Oils – Present Status and Future Perspectives. Medicines, 4 (3), 58. https://doi.org/10.3390/medicines4030058
- Kalemba, D., Kunicka, A. (2003). Antibacterial and Antifungal Properties of Essential Oils. Current Medicinal Chemistry, 10 (10), 813–829. https://doi.org/10.2174/0929867033457719
- Marzoug, H. N. B., Romdhane, M., Lebrihi, A., Mathieu, F., Couderc, F., Abderraba, M. et al. (2011). Eucalyptus oleosa Essential Oils: Chemical Composition and Antimicrobial and Antioxidant Activities of the Oils from Different Plant Parts (Stems, Leaves, Flowers and Fruits). Molecules, 16 (2), 1695–1709. https://doi.org/10.3390/molecules16021695
- Takahashi, T., Kokubo, R., Sakaino, M. (2004). Antimicrobial activities of eucalyptus leaf extracts and flavonoids from Eucalyptus maculata. Letters in Applied Microbiology, 39 (1), 60–64. https://doi.org/10.1111/j.1472-765x.2004.01538.x
- Bachir, R. G., Benali, M. (2012). Antibacterial activity of the essential oils from the leaves of Eucalyptus globulus against Escherichia coli and Staphylococcus aureus. Asian Pacific Journal of Tropical Biomedicine, 2 (9), 739–742. https://doi.org/10.1016/s2221-1691(12)60220-2
- Kumari, P. K., Akhila, S., Rao, Y. S., Devi, B. R. (2019). Alternative to artificial preservatives. Systematic Reviews in Pharmacy, 10 (1), 99–102.
- Kheirkhah Rahimabadi, S., Tabatabaee Bafroee, A. S., Khalili Hadad, B. (2022). Development of a Natural Preservative System in Fluticasone Propionate Nasal Spray Formulation Using Eucalyptus globulus Essential Oil. Jundishapur Journal of Natural Pharmaceutical Products, 17 (4). https://doi.org/10.5812/jjnpp-127106
- Caimmi, D., Neukirch, C., Louis, R., Malard, O., Thabut, G., Demoly, P. (2020). Effect of the Use of Intranasal Spray of Essential Oils in Patients with Perennial Allergic Rhinitis: A Prospective Study. International Archives of Allergy and Immunology, 182 (3), 182–189. https://doi.org/10.1159/000510592
- European Pharmacopoeia (2023). Strasbourg: Council of Europe.
- Pat. CN101928247A (2012). Method for synthesizing xylometazoline hydrochloride compound. Published: 09.05.2012.
- Pat. CN103351343A (2013). Synthetic method for xylometazoline hydrochloride (2013). Published: 16.10.2013.
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Tetiana Solominchuk, Vitalii Rudiuk, Nataliia Smielova, Alinа Deyneka, Tetiana Nesteruk, Victoriya Georgiyants

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.







