Ультра ефективна рідинна хроматографія – мас-спектрометричні методики визначення залишкових кількостей раміприлу та гідрохлоротіазиду для контролю очистки обладнання
DOI:
https://doi.org/10.15587/2519-4852.2024.310759Ключові слова:
гідрохлортіазид, раміприл, контроль очистки обладнання, валідація, УЕРХАнотація
Контроль повноти очищення обладнання є важливим для запобігання перехресної контамінації лікарських засобів. Тому необхідно розробити швидкі й чутливі методики дослідження залишкових кількостей активних інгредієнтів на поверхнях технологічного обладнання.
Мета роботи – розробити і валідувати аналітичні методики визначення раміприлу та гідрохлортіазиду у промивних водах методом ультра-ефективної рідинної хроматографії з МС- детектуванням.
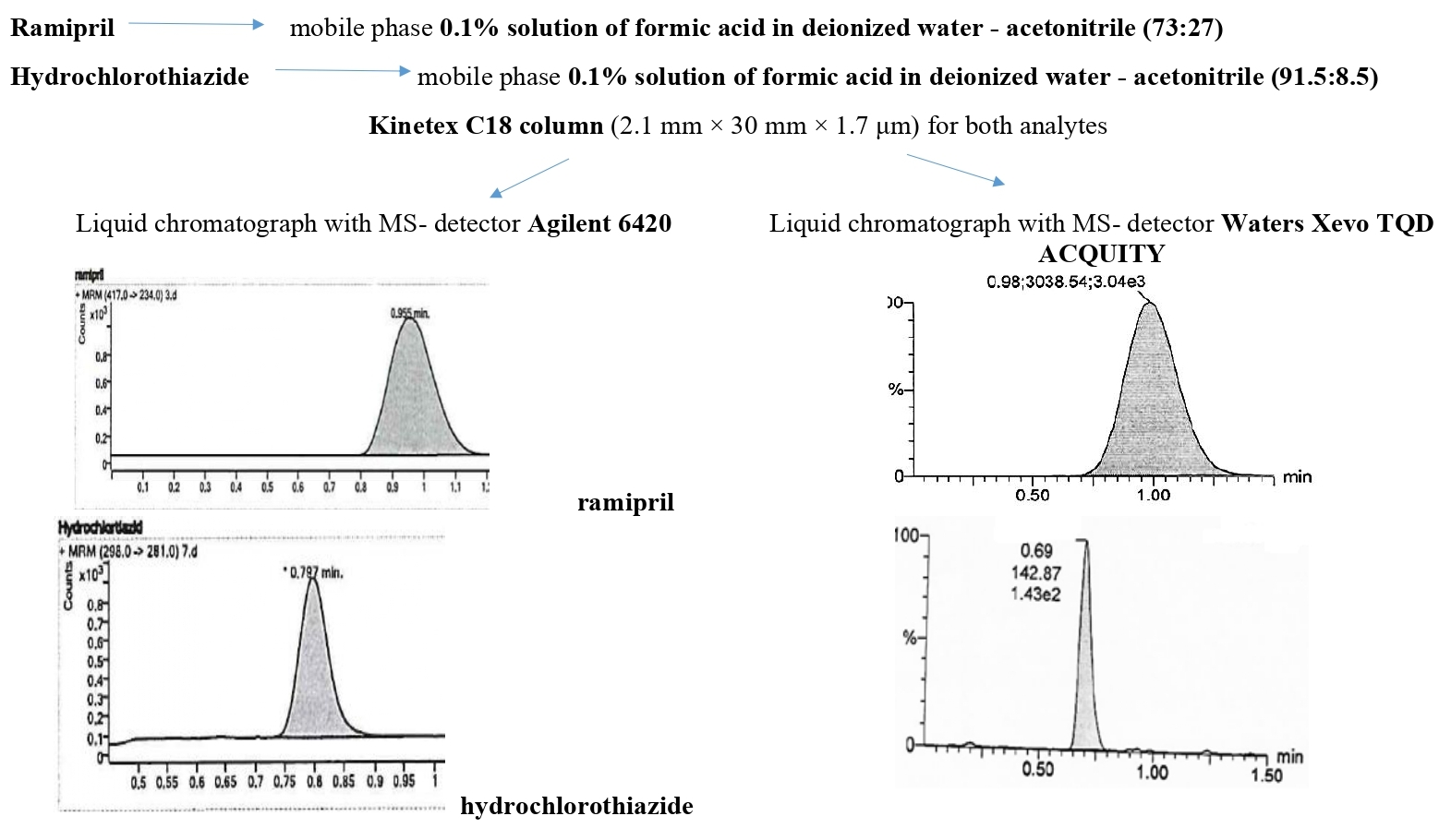
Матеріали та методи. При проведенні дослідження використовували стандартні зразки раміприлу (USP RS) та гідрохлортіазиду (USP RS), а також реактиви класу А. Зразки аналізували на рідинному хроматографі з МС- детектором (Agilent 6420 та Waters Xevo TQD ACQUITY). Використовували колонку Kinetex С18 (2.1 мм × 30 мм × 1.7 мкм); рухома фаза – 0.1 % розчин мурашиної кислоти в деіонізованій воді - Ацетонітрил (співвідношення 73:27 для визначення раміприлу та 91.5:8.5 для визначення гідрохлортіазиду); швидкість рухомої фази 0.4 мл/хв для визначення раміприлу та 0.35 мл/хв для визначення гідрохлортіазиду; температура колонки 45 °С для визначення раміприлу та 40 °С для визначення гідрохлортіазиду, режим іонізації - електроспрей у позитивному режимі; параметри детектування - режим реєстрації дочірнього іону 417 → 234 m/z для визначення раміприлу та 298 → 281 m/z для визначення гідрохлортіазиду.
Результати та обговорення. Розроблено методики визначення раміприлу та гідрохлортіазиду у промивних водах методом ультра-ефективної рідинної хроматографії з МС- детектуванням. Розроблені методики має достатню лінійність, правильність і прецизійність. Чутливість методик підтверджено на рівні 0.0026 мкг/мл. Методики можна застосовувати в діапазоні концентрацій 0.0026 – 0.0255 мкг/мл.
Висновки. Розроблено та валідовано аналітичні методики визначення раміприлу та гідрохлортіазиду у промивних водах
Посилання
- Good Manufacturing Practice (GMP) guidelines (EudraLex – Volume 4). Available at: https://health.ec.europa.eu/medicinal-products/eudralex/eudralex-volume-4_en Last accessed: 06.06.2024
- Resto, W., Hernández, D., Rey, R., Colón, H., Zayas, J. (2007). Cleaning validation 2: Development and validation of an ion chromatographic method for the detection of traces of CIP-100 detergent. Journal of Pharmaceutical and Biomedical Analysis, 44 (1), 265–269. https://doi.org/10.1016/j.jpba.2007.01.037
- Bubnič, Z., Urleb, U., Kreft, K., Veber, M. (2010). The application of atomic absorption spectrometry for the determination of residual active pharmaceutical ingredients in cleaning validation samples. Drug Development and Industrial Pharmacy, 37 (3), 281–289. https://doi.org/10.3109/03639045.2010.509726
- Kolodsick, K. J., Phillips, H., Feng, J., Kingsmill, C. A. (2006). Enhancing Drug development by Applying LC-MS-MS for Cleaning Validation in Manufacturing Equipment. Pharmaceutical Technology, 30 (2), 56–72.
- Heidbreder, D., Froer, K.L., Bauer, B., Cairns, V., Breitstadt, A. (1991). Efficacy and Safety of Ramipril in Combination with Hydrochlorothiazide Results of a Long-Term Study. Journal of Cardiovascular Pharmacology, 18, 169–173. https://doi.org/10.1097/00005344-199100182-00039
- Lakshmi, K. S., Sivasubramanian, L. (2010). A stability indicating hplc method for the simultaneous determination of valsartan and ramipril in binary combination. Journal of the Chilean Chemical Society, 55 (2), 223–226. https://doi.org/10.4067/s0717-97072010000200017
- Bhagwate, S., Gaikwad, N. (2013). Stability indicating HPLC method for the determination of hydrochlorothiazide in pharmaceutical dosage form. Journal of Applied Pharmaceutical Science, 3, 88–92. https://doi.org/10.7324/japs.2013.30215
- Szpot, P., Buszewicz, G. (2015). Determination of ramipril in human plasma and its fragmentation by UPLC-Q-TOF-MS with positive electrospray ionization. Acta Pharmaceutica, 65 (2), 159–169. https://doi.org/10.1515/acph-2015-0018
- Babu, K. A., Kumar, G. V., Sivasubramanian, L. (2011). Simultaneous estimation of ramipril and amlodipine in pharmaceutical dosage form by RP-HPLC method. International Journal of Pharmacy and Pharmaceutical Sciences, 3 (4), 196–198.
- Dai, S.-Y., Qiu, S.-T., Wu, W., Fu, C.-M. (2013). Development and validation of an rp-hplc method for simultaneous determination of Ramipril and Amlodipine in tablets. Journal of Pharmaceutical Analysis, 3 (6), 440–446. https://doi.org/10.1016/j.jpha.2013.09.002
- Elshanawane, A. A., Mostafa, S. M., Elgawish, M. S. (2008). Application of a Validated, Stability-Indicating LC Method to Stress Degradation Studies of Ramipril and Moexipril.HCl. Chromatographia, 67 (7-8), 567–573. https://doi.org/10.1365/s10337-008-0544-3
- Gupta, K. R., Wankhede, S. B., Tajne, M. R., Wadodkar, S. G. (2007). Simultaneous determination of Amlodipine and Ramipril by high performance thin layer chromatography. Asian Journal of Chemistry, 19, 4177–4182.
- Logoyda, L. (2019). Analysis of approaches to the development and validation of the methods of analysis of some active pharmaceutical ingredients from the group of angiotensin converting enzyme inhibitors in drugs and biological liquids. International Journal of Applied Pharmaceutics, 11 (4). https://doi.org/10.22159/ijap.2019v11i4.32420
- Kumar, A. M., Kumar, P. V., Nasare, M., Rao, V., Parasad, V. V. L., Diwan, V. P. (2012). Isocratic RP-HPLC estimation of Ramipril and Amlodipine in pharmaceutical dosage form. Journal of Advanced Pharmacy Education and Research, 2, 137–145.
- Maste, M. M., Kalekar, M. C., Kadian, N., Bhat, A. R. (2011). Development and validation of RP-HPLC method for simultaneous estimation of Amlodipine and Ramipril in bulk and tablet dosage form. Asian Journal of Research in Chemistry, 4, 1210–1213.
- Panchal, H. J., Suhagia, B. N., Patel, N. J., Rathod, I. S., Patel, B. H. (2008). Simultaneous Estimation of Atorvastatin Calcium, Ramipril and Aspirin in Capsule Dosage Form by RP-LC. Chromatographia, 69 (1-2), 91–95. https://doi.org/10.1365/s10337-008-0831-z
- Patel, J., Patel, M. (2014). RP-HPLC method development and validation for the simultaneous estimation of ramipril and amlodipine besylate in capsule dosage form. Journal of Chemical and Pharmaceutical Research, 6, 725–733.
- Patole, S. M., Khodke, A. S., Potale, L. V., Damle, M. C. (2010). A validated HPLC method for analysis of atorvastatin calcium, ramipril and asprin as the bulk drug and in combined capsule dosage forms. International Journal of Pharmaceutical Sciences Review and Research, 4, 40–45.
- Rajput, P. S., Kaur, A., Gill, N. K., Mittal, K., Sarma, G. S. (2012). Simultaneous estimation of ramipril and amlodipine in bulk and tablet dosage form by RP-HPLC method. Journal of Applied Pharmaceutical Science, 2 (7), 160–165. https://doi.org/10.7324/japs.2012.2724
- Dheeravath, S. N., Ramadevi, K., Saraswathi, Z., Maniklal, D., Bhagawan. D, Bhagawan. D. (2012). RP-HPLC method development for simultaneous determination of the drugs Ramipril and Amlodipine. International Journal of Scientific Research, 2 (2), 364–367. https://doi.org/10.15373/22778179/feb2013/123
- Sharma, R., Khanna, S., Mishra, G. P. (2011). Development and Validation of RP‐HPLC Method for Simultaneous Estimation of Ramipril, Aspirin and Atorvastatin in Pharmaceutical Preparations. Journal of Chemistry, 9 (4), 2177–2184. Portico. https://doi.org/10.1155/2012/891695
- Rao, S., Srinivas, K. (2010). RP-HPLC method for the determination of losartan potassium and ramipril in combined dosage form. Indian Journal of Pharmaceutical Sciences, 72 (1), 108–111. https://doi.org/10.4103/0250-474x.62243
- Lincy, J., Mathew, G., Venkata, R. (2018). Simultaneous estimation of Atorvastatin and Ramipril by RP-HPLC and spectroscopy. Pakistan Journal of Pharmaceutical Sciences, 21, 282–284.
- Sharma, A., Shah, B., Patel, B. (2010). Scholars Research Library Simultaneous Estimation of Atorvastatin Calcium, Ramipril and Aspirin in Capsule Dosage Form Using HPTLC. Der Pharma Chem., 2, 10–16.
- Żuromska-Witek, B., Stolarczyk, M., Szlósarczyk, M., Kielar, S., Hubicka, U. (2022). Simple, Accurate and Multianalyte Determination of Thirteen Active Pharmaceutical Ingredients in Polypills by HPLC-DAD. Chemosensors, 11 (1), 25. https://doi.org/10.3390/chemosensors11010025
- De Diego, M., Godoy, G., Mennickent, S., Olivares, M., Godoy, R. (2010). Stress degradation studies of ramipril by a validated stability-indicating liquid chromatographic method. Journal of the Chilean Chemical Society, 55 (4), 450–453. https://doi.org/10.4067/s0717-97072010000400008
- Typlynska, K., Kondratova, Y., Logoyda, L. (2023). Development of Methods of Quality Control of the Tablets «Ramipril». Scientia Pharmaceutica, 91 (2), 21. https://doi.org/10.3390/scipharm91020021
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Kateryna Typlynska, Yuliya Kondratova, Mariana Horyn, Liliya Logoyda

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.







