Підхід до валідації технологічного процесу виготовлення медичних виробів на прикладі імплантатів ін'єкційних на основі гіалуронової кислоти
DOI:
https://doi.org/10.15587/2519-4852.2024.319456Ключові слова:
технологічний процес, валідація, діаграма Ісікава, медичні вироби, імплантати ін’єкційні, гіалуронова кислотаАнотація
Мета. Валідація технологічного процесу виготовлення медичних виробів є необхідною умовою підтвердження здатності виробника безперервно виготовляти якісні медичні вироби, зменшити або усунути кількість дефектів, підвищити рівень якості продукції, а також є однією з основних вимог до сертифікації продукції на ринку Європейського Союзу. Враховуючи велику різноманітність типів медичних виробів (від пластирів до наповнених шприців), на відміну від лікарських засобів, процедура валідації медичних виробів не містить чітких рекомендацій та інструкцій.
Матеріали та методи. Предметом даної статті є визначення підходу до валідації технологічного процесу виготовлення виробів медичного призначення на прикладі ін’єкційних імплантатів на основі стабілізованої гіалуронової кислоти з використанням досвіду серійного виробництва зазначеного виду продукції на промислових умовах та нормативних вимог України та Європейського Союзу.
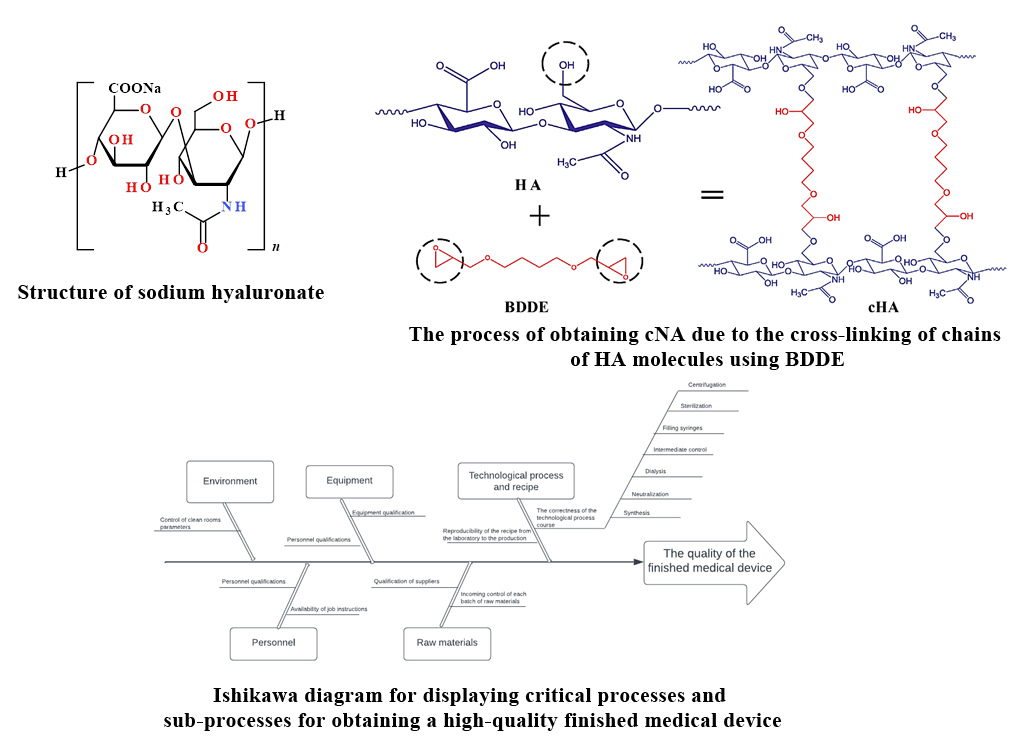
Результати. У статті представлені відомості про природу гіалуронової кислоти, її структуру, джерела і способи отримання, сферу застосування.
Визначення критичних точок технологічного процесу проводилось методом оцінки ризику з використанням підходу формування діаграми Ісікави, тобто «аналізу причинно-наслідкових зв’язків».
Основні етапи аналізу причинно-наслідкових зв'язків наступні:
– визначення процесу, що підлягає аналізу (отримання високоякісної готової продукції) та підпроцесів, що впливають на кінцевий результат;
– визначення основних категорій впливу на процес, відображених блоками на діаграмі Ісікави.
Результат такого аналізу відображається у вигляді згаданої вище діаграми Ісікава («риб'яча кістка»).
Висновки. Визначено підпроцеси, які мають основний вплив на технологічний процес виготовлення медичного виробу. Ці елементи є критичними точками, які підлягають валідації. У статті описано вплив кожного з цих елементів, їх основні параметри та допустимі діапазони роботи, а також представлено процес валідації та підтвердження валідності відповідної технології
Посилання
- ISO 14971:2019 Medical devices – Application of risk management to medical devices (2019). Available at: https://www.iso.org/standard/72704.html
- European Pharmacopoeia 11.0. Available at: https://www.edqm.eu/en/european-pharmacopoeia-ph.-eur.-11th-edition
- Romagnoli, M., Belmontesi, M. (2008). Hyaluronic acid–based fillers: theory and practice. Clinics in Dermatology, 26 (2), 123–159. https://doi.org/10.1016/j.clindermatol.2007.09.001
- Zhang, Y., Tan, W., Zhang, Y., Mao, H., Shi, S., Duan, L., Wang, H., Yu, J. (2019). Ultrasensitive and selective detection of Staphylococcus aureus using a novel IgY-based colorimetric platform. Biosensors and Bioelectronics, 142, 111570. https://doi.org/10.1016/j.bios.2019.111570
- Patil, K. P., Kamalja, K. K., Chaudhari, B. L. (2011). Optimization of medium components for hyaluronic acid production by Streptococcus zooepidemicus MTCC 3523 using a statistical approach. Carbohydrate Polymers, 86 (4), 1573–1577. https://doi.org/10.1016/j.carbpol.2011.06.065
- Huang, W.-C., Chen, S.-J., Chen, T.-L. (2008). Production of hyaluronic acid by repeated batch fermentation. Biochemical Engineering Journal, 40 (3), 460–464. https://doi.org/10.1016/j.bej.2008.01.021
- Ogrodowski, C. S., Hokka, C. O., Santana, M. H. A. (2005). Production of hyaluronic acid. Applied Biochemistry and Biotechnology, 122, 753–761.
- Liu, L., Du, G., Chen, J., Zhu, Y., Wang, M., Sun, J. (2009). Microbial production of low molecular weight hyaluronic acid by adding hydrogen peroxide and ascorbate in batch culture of Streptococcus zooepidemicus. Bioresource Technology, 100 (1), 362–367. https://doi.org/10.1016/j.biortech.2008.05.040
- Rangaswamy, V., Jain, D. (2007). An efficient process for production and purification of hyaluronic acid from Streptococcus equi subsp. zooepidemicus. Biotechnology Letters, 30 (3), 493–496. https://doi.org/10.1007/s10529-007-9562-8
- Liu, W., Ma, M., Lei, Z., Xiong, Z., Tao, T., Lei, P. et al. (2022). Intra-articular injectable hydroxypropyl chitin/hyaluronic acid hydrogel as bio-lubricant to attenuate osteoarthritis progression. Materials & Design, 217, 110579. https://doi.org/10.1016/j.matdes.2022.110579
- Belk, J. W., Lim, J. J., Keeter, C., McCulloch, P. C., Houck, D. A., McCarty, E. C. et al. (2023). Patients With Knee Osteoarthritis Who Receive Platelet-Rich Plasma or Bone Marrow Aspirate Concentrate Injections Have Better Outcomes Than Patients Who Receive Hyaluronic Acid: Systematic Review and Meta-analysis. Arthroscopy: The Journal of Arthroscopic & Related Surgery, 39 (7), 1714–1734. https://doi.org/10.1016/j.arthro.2023.03.001
- Gobbi, A., Morales, M., Avio, G., D’Ambrosi, R. (2022). Double-blinded prospective randomized clinical trial in knee joint osteoarthritis treatment: safety assessment and performance of trehalose hyaluronic acid versus standard infiltrative therapy based on medium-weight sodium hyaluronate. Journal of Cartilage & Joint Preservation, 2 (3), 100043. https://doi.org/10.1016/j.jcjp.2022.100043
- Rai, V. K., Saha, I., Alam, M., Nishchaya, K., Ghosh, G., Rath, G. (2023). Microneedle arrays for cutaneous and transcutaneous drug delivery, disease diagnosis, and cosmetic aid. Journal of Drug Delivery Science and Technology, 79, 104058. https://doi.org/10.1016/j.jddst.2022.104058
- Shimizu, Y., Ntege, E. H., Sunami, H. (2022). Current regenerative medicine-based approaches for skin regeneration: A review of literature and a report on clinical applications in Japan. Regenerative Therapy, 21, 73–80. https://doi.org/10.1016/j.reth.2022.05.008
- Huynh, A., Priefer, R. (2020). Hyaluronic acid applications in ophthalmology, rheumatology, and dermatology. Carbohydrate Research, 489, 107950. https://doi.org/10.1016/j.carres.2020.107950
- Soares, D. J., Zuliani, G. F. (2022). Orbital post-septal hyaluronic acid: An iatrogenic etiology compounding lower eyelid steatoblepharon. JPRAS Open, 34, 173–177. https://doi.org/10.1016/j.jpra.2022.09.010
- Mateo-Orobia, A. J., del Prado Sanz, E., Blasco-Martínez, A., Pablo-Júlvez, L. E., Farrant, S., Chiambaretta, F. (2023). Efficacy of artificial tears containing trehalose and hyaluronic acid for dry eye disease in women aged 42–54 versus ≥ 55 years. Contact Lens and Anterior Eye, 46 (4), 101845. https://doi.org/10.1016/j.clae.2023.101845
- De Boulle, K., Glogau, R., Kono, T., Nathan, M., Tezel, A., Roca-Martinez, J.-X. et al. (2013). A Review of the Metabolism of 1,4-Butanediol Diglycidyl Ether-Crosslinked Hyaluronic Acid Dermal Fillers. Dermatologic Surgery, 39 (12), 1758–1766. https://doi.org/10.1111/dsu.12301
- Schuurmans, Carl. C. L., Mihajlovic, M., Hiemstra, C., Ito, K., Hennink, W. E., Vermonden, T. (2021). Hyaluronic acid and chondroitin sulfate (meth)acrylate-based hydrogels for tissue engineering: Synthesis, characteristics and pre-clinical evaluation. Biomaterials, 268, 120602. https://doi.org/10.1016/j.biomaterials.2020.120602
- Schanté, C. E., Zuber, G., Herlin, C., Vandamme, T. F. (2011). Chemical modifications of hyaluronic acid for the synthesis of derivatives for a broad range of biomedical applications. Carbohydrate Polymers, 85 (3), 469–489. https://doi.org/10.1016/j.carbpol.2011.03.019
- Zhang, J. N., Chen, B. Z., Ashfaq, M., Zhang, X. P., Guo, X. D. (2018). Development of a BDDE-crosslinked hyaluronic acid based microneedles patch as a dermal filler for anti-ageing treatment. Journal of Industrial and Engineering Chemistry, 65, 363–369. https://doi.org/10.1016/j.jiec.2018.05.007
- Al-Sibani, M., Al-Harrasi, A., Neubert, R. H. H. (2016). Study of the effect of mixing approach on cross-linking efficiency of hyaluronic acid-based hydrogel cross-linked with 1,4-butanediol diglycidyl ether. European Journal of Pharmaceutical Sciences, 91, 131–137. https://doi.org/10.1016/j.ejps.2016.06.010
- Kenne, L., Gohil, S., Nilsson, E. M., Karlsson, A., Ericsson, D., Helander Kenne, A., Nord, L. I. (2013). Modification and cross-linking parameters in hyaluronic acid hydrogels – Definitions and analytical methods. Carbohydrate Polymers, 91 (1), 410–418. https://doi.org/10.1016/j.carbpol.2012.08.066
- ISO 13485:2016 Medical devices – Quality management systems – Requirements for regulatory purposes (2016). Available at: https://www.iso.org/ru/standard/59752.html
- Zhao, Y., Sheng, K., Wang, Z., Zhang, X., HengyiYang, Miao, R. (2017). Process Validation and Revalidation in Medical Device Production. Procedia Engineering, 174, 686–692. https://doi.org/10.1016/j.proeng.2017.01.207
- Pitarresi, G., Palumbo, F. S., Tripodo, G., Cavallaro, G., Giammona, G. (2007). Preparation and characterization of new hydrogels based on hyaluronic acid and α,β-polyaspartylhydrazide. European Polymer Journal, 43 (9), 3953–3962. https://doi.org/10.1016/j.eurpolymj.2007.06.027
- DSTU IEC/ISO 31010:2013 Risk management. Methods of general risk assessment. Available at: https://khoda.gov.ua/image/catalog/files/dstu%2031010.pdf
- ISO 14644-1:2015 Cleanrooms and associated controlled environments. Part 1: Classification of air cleaness. Available at: https://www.iso.org/standard/53394.html
- On the approval of the Technical Regulation on medical devices (2013). Resolution No. 753. 02.10.2013.
- Medical Device Regulation 2017/745. Available at: https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=celex%3A32017R0745
- U.S. Food and Drug Adminictration. Available at: https://www.fda.gov/
- GHTF/SG3/N99-10:2015 Quality management systems. Guidance on process validation. The document is harmonized to GHTF/SG3/N99-10:2004 Quality Management Systems – Process Validation Guidance (2015). Edition 2.
- EMA/CHMP/CVMP/QWP/749073/2016 EMA Guideline on process validation for finished products – information and data to be provided in regulatory submission (2016).
- ICH Q7 Current Step 4 version (2000).
- EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use Volume 4 (2022). Available at: https://health.ec.europa.eu/latest-updates/eudralex-volume-4-eu-guidelines-good-manufacturing-practice-medicinal-products-human-and-veterinary-2022-02-21_en
- СТ-Н МОЗУ 42-4.0:2015 MEDICINES Good Manufacturing Practice.
- Inna Bondarets, Lyudmila Sidorenko, Victoriya Georgiyants, Volodymyr Mishchenko. Bondarets, I., Sidorenko, L. et al. (2022). Regulatory and risk oriented approach to the design and development of medical devices in accordance with Ukraine regulations. Pharmacia, 69 (2), 493–500. https://doi.org/10.3897/pharmacia.69.e82316
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Inna Bondarets, Lyudmila Sidorenko, Olga Antonenko, Serhii Lebed, Victoriya Georgiyants

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.








