Вплив природних олігорибонуклеотидів у комплексах з D-манітолом на ріст пухлин та експресію маркерів імунних клітин в моделі меланоми миші В16
DOI:
https://doi.org/10.15587/2519-4852.2025.326767Ключові слова:
природні олігорибонуклеотиди, меланома B16, утворення пухлин, цитотоксичність, in vivo модель, ракАнотація
Рак залишається однією з провідних причин смертності у світі, причому хронічне запалення відіграє критичну роль у ініціації та прогресуванні пухлин. Природні олігорибонуклеотиди у комплексах з D-манітолом (OРН-D-M), отримані з дріжджової РНК, демонструють протизапальні та імуномодулюючі ефекти у різних моделях захворювань. Попередні дослідження показали їхню цитотоксичність щодо клітинної лінії меланоми мишей B16 in vitro. Метою цього дослідження було оцінити антитуморні властивості OРН-D-M у тваринній моделі меланоми B16.
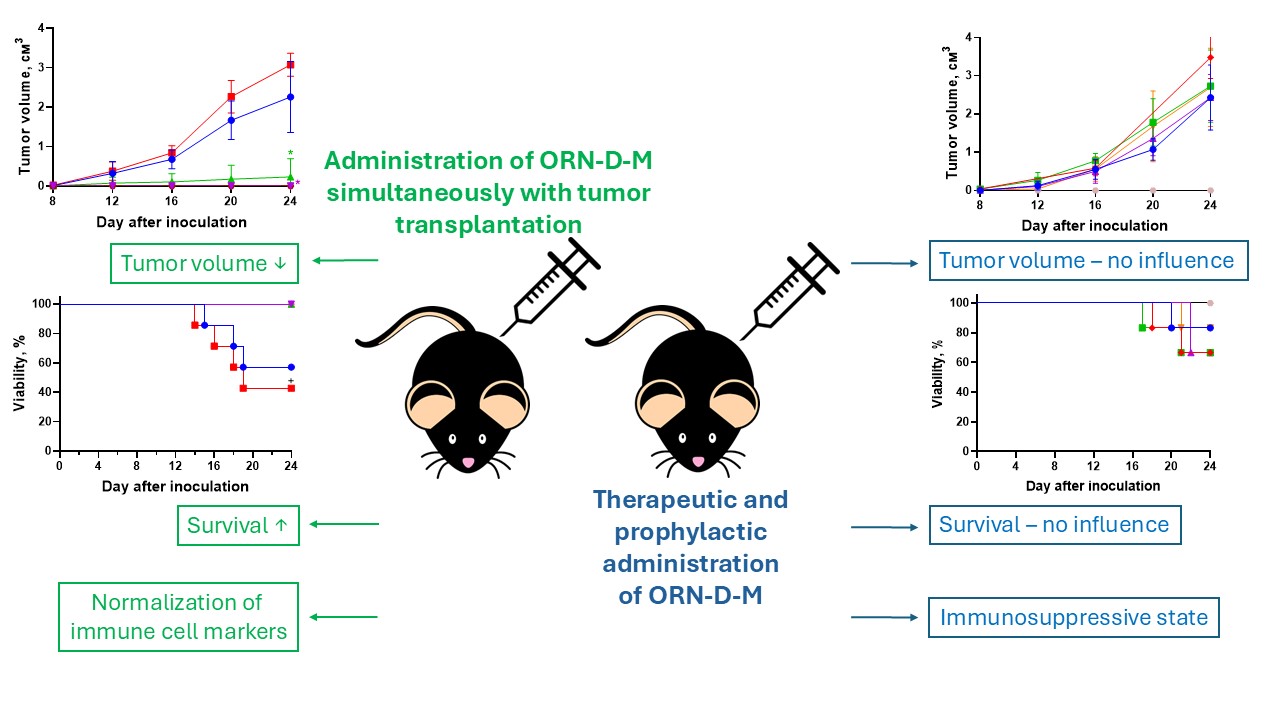
Матеріали та методи. Модель меланоми В16 отримували шляхом трансплантації клітин B16 мишам C57BL/6. OРН-D-M тваринам вводили у різних дозах за допомогою варіативних шляхів (підшкірно, перорально, внутрішньочеревно) та за профілактичним й терапевтичним режимами введення, а також сумісно при трансплантації пухлинних клітин. Оцінювали динаміку росту пухлин, виживаність, а також експресію генів маркерів імунних клітин у периферичній крові (Cd3, Cd247, Cd4, Cd8, Cd68) методом RT-qPCR.
Результати. Встановлено, що одночасне введення OРН-D-M із трансплантацією пухлинних клітин призводило до дозозалежного інгібування пухлиноутворення. Однак профілактичне та терапевтичне введення препарату після трансплантації пухлини не продемонструвало значущих ефектів. Крім того, OРН-D-M не впливав на експресію мРНК маркерів імунних клітин на пізніх стадіях меланоми B16.
Висновок. OРН-D-M виявляє дозозалежний цитотоксичний ефект при одночасному введенні з пухлинними клітинами, але не ефективний при терапевтичному чи профілактичному режимах. Подальші дослідження повинні зосередитись на оптимізації систем цільової доставки препарату для покращення його стабільності та ефективності в терапії раку
Спонсор дослідження
- This work was supported by Simons Support Grant (1290589, Ivanna Prylutska, Zenoviy Tkachuk).
Посилання
- Aggarwal, B. B., Vijayalekshmi, R. V., Sung, B. (2009). Targeting Inflammatory Pathways for Prevention and Therapy of Cancer: Short-Term Friend, Long-Term Foe. Clinical Cancer Research, 15 (2), 425–430. https://doi.org/10.1158/1078-0432.ccr-08-0149
- Grivennikov, S. I., Greten, F. R., Karin, M. (2010). Immunity, Inflammation, and Cancer. Cell, 140 (6), 883–899. https://doi.org/10.1016/j.cell.2010.01.025
- Gerashchenko, G. V., Kashuba, V. I., Tukalo, M. A. (2023). Key models and theories of carcinogenesis. Biopolymers and Cell, 39 (3), 161–169. https://doi.org/10.7124/bc.000a99
- Fitzgerald, K. A., Kagan, J. C. (2020). Toll-like Receptors and the Control of Immunity. Cell, 180 (6), 1044–1066. https://doi.org/10.1016/j.cell.2020.02.041
- Urban-Wojciuk, Z., Khan, M. M., Oyler, B. L., Fåhraeus, R., Marek-Trzonkowska, N., Nita-Lazar, A. et al. (2019). The Role of TLRs in Anti-cancer Immunity and Tumor Rejection. Frontiers in Immunology, 10. https://doi.org/10.3389/fimmu.2019.02388
- Rolfo, C., Giovannetti, E., Martinez, P., McCue, S., Naing, A. (2023). Applications and clinical trial landscape using Toll-like receptor agonists to reduce the toll of cancer. Npj Precision Oncology, 7 (1). https://doi.org/10.1038/s41698-023-00364-1
- Kawai, K., Miyazaki, J., Joraku, A., Nishiyama, H., Akaza, H. (2013). Bacillus Calmette-Guerin (BCG) Immunotherapy for Bladder Cancer: Current Understanding and Perspectives on Engineered BCG Vaccine. Cancer Science, 104(1), 22–27. Portico. https://doi.org/10.1111/cas.12075
- Salaun, B., Coste, I., Rissoan, M.-C., Lebecque, S. J., Renno, T. (2006). TLR3 Can Directly Trigger Apoptosis in Human Cancer Cells. The Journal of Immunology, 176 (8), 4894–4901. https://doi.org/10.4049/jimmunol.176.8.4894
- Hou, J., Karin, M., Sun, B. (2021). Targeting cancer-promoting inflammation – have anti-inflammatory therapies come of age? Nature Reviews Clinical Oncology, 18 (5), 261–279. https://doi.org/10.1038/s41571-020-00459-9
- Thiruchenthooran, V., Sánchez-López, E., Gliszczyńska, A. (2023). Perspectives of the Application of Non-Steroidal Anti-Inflammatory Drugs in Cancer Therapy: Attempts to Overcome Their Unfavorable Side Effects. Cancers, 15 (2), 475. https://doi.org/10.3390/cancers15020475
- Tkachuk, Z. (2013). Pat. No. US8420617B2 USA. Multiantivirus Compound, Composition and Method for Treatment of Virus Diseases. published: 16.04.2013.
- Tkachuk, Z. Yu., Tkachuk, V. V., Tkachuk, L. V. (2006). The study on membrane-stabilizing and anti-inflammatory actions of yeast RNA in vivo and in vitro. Biopolymers and Cell, 22 (2), 109–116. https://doi.org/10.7124/bc.000723
- Frolov, V. M., Sotska, Ya. A., Kruglova, O. V., Tkachuk, Z. Yu. (2012). Influence of antiviral drug nuclex on the cellular immunity at the patients with chronic viral hepatitis C. Ukrainskyi morfolohichnyi almanakh, 10, 99–105.
- Kraievska, I. M., Tkachuk, Z. Yu. (2023). Effect of complexes of natural oligoribonucleotides with D-mannitol on the viability of cell cultures of different origin. Biopolymers and Cell, 39 (3), 220–230. https://doi.org/10.7124/bc.000a93
- Prylutska, I. M., Tkachuk, Z. Yu. (2024). Oligoribonucleotides in complexes with D-mannitol alter cell cycle and cause apoptosis in murine melanoma B16 cells. Biopolymers and Cell, 40 (2), 118–126. https://doi.org/10.7124/bc.000ab2
- Overwijk, W. W., Restifo, N. P. (2000). B16 as a Mouse Model for Human Melanoma. Current Protocols in Immunology, 39 (1). https://doi.org/10.1002/0471142735.im2001s39
- Stefanov, O. V.; Litvinova, N. V., Filonenko-Patrusheva, M. A., Frantsuzova, S. B., Khrapak, V. V. (Eds.) (2001). Doklinichni Doslidzhennnia Likarskykh Zasobiv. Kyiv: Vydavnychyi dim «Avitsena».
- Workman, P., Aboagye, E. O., Balkwill, F., Balmain, A., Bruder, G., Chaplin, D. J. et al. (2010). Guidelines for the welfare and use of animals in cancer research. British Journal of Cancer, 102 (11), 1555–1577. https://doi.org/10.1038/sj.bjc.6605642
- Faustino-Rocha, A., Oliveira, P. A., Pinho-Oliveira, J., Teixeira-Guedes, C., Soares-Maia, R., da Costa, R. G. et al. (2013). Estimation of rat mammary tumor volume using caliper and ultrasonography measurements. Lab Animal, 42 (6), 217–224. https://doi.org/10.1038/laban.254
- Kulyk, O., Krivoshey, A., Kolosova, O., Prylutska, I., Vasiliu, T., Puf, R. et al. (2024). Nucleic acid-binding bis-acridine orange dyes with improved properties for bioimaging and PCR applications. Journal of Materials Chemistry B, 12 (46), 11968–11982. https://doi.org/10.1039/d4tb01775g
- Gerashchenko, G. V., Vagina, I. M., Vagin, Yu. V., Kashuba, V. I. (2020). Pattern of expression of immune- and stroma-associated genes in blood of mice with experimental B16 melanoma. The Ukrainian Biochemical Journal, 92 (1), 5–11. https://doi.org/10.15407/ubj92.01.005
- Kamran, N., Li, Y., Sierra, M., Alghamri, M. S., Kadiyala, P., Appelman, H. D., Edwards, M., Lowenstein, P. R., Castro, M. G. (2017). Melanoma induced immunosuppression is mediated by hematopoietic dysregulation. OncoImmunology, 7 (3), e1408750. https://doi.org/10.1080/2162402x.2017.1408750
- King, K. Y., Goodell, M. A. (2011). Inflammatory modulation of HSCs: viewing the HSC as a foundation for the immune response. Nature Reviews Immunology, 11 (10), 685–692. https://doi.org/10.1038/nri3062
- Duan, T., Du, Y., Xing, C., Wang, H. Y., Wang, R.-F. (2022). Toll-Like Receptor Signaling and Its Role in Cell-Mediated Immunity. Frontiers in Immunology, 13. https://doi.org/10.3389/fimmu.2022.812774
- Takizawa, H., Boettcher, S., Manz, M. G. (2012). Demand-adapted regulation of early hematopoiesis in infection and inflammation. Blood, 119 (13), 2991–3002. https://doi.org/10.1182/blood-2011-12-380113
- Nishii, N., Tachinami, H., Kondo, Y., Xia, Y., Kashima, Y., Ohno, T. et al. (2018). Systemic administration of a TLR7 agonist attenuates regulatory T cells by dendritic cell modification and overcomes resistance to PD-L1 blockade therapy. Oncotarget, 9 (17), 13301–13312. https://doi.org/10.18632/oncotarget.24327
- Lemke-Miltner, C. D., Blackwell, S. E., Yin, C., Krug, A. E., Morris, A. J., Krieg, A. M., Weiner, G. J. (2020). Antibody Opsonization of a TLR9 Agonist–Containing Virus-like Particle Enhances in Situ Immunization. The Journal of Immunology, 204 (5), 1386–1394. https://doi.org/10.4049/jimmunol.1900742
- Arca, M. J., Krauss, J. C., Strome, S. E., Cameron, M. J., Chang, A. E. (1996). Diverse manifestations of tumorigenicity and immunogenicity displayed by the poorly immunogenic B16-BL6 melanoma transduced with cytokine genes. Cancer Immunology, Immunotherapy, 42 (4), 237–245. https://doi.org/10.1007/s002620050276
- Medler, T. R., Blair, T. C., Crittenden, M. R., Gough, M. J. (2021). Defining Immunogenic and Radioimmunogenic Tumors. Frontiers in Oncology, 11. https://doi.org/10.3389/fonc.2021.667075
- Voskoglou-Nomikos, T., Pater, J., Seymour, L. (2003). Clinical Predictive Value of the in Vitro Cell Line, Human Xenograft, and Mouse Allograft Preclinical Cancer Models. Clinical Cancer Research, 9, 4227–4239.
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2025 Ivanna Prylutska, Zenoviy Tkachuk

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.








