Комбіновані метанольні екстракти вибраних лікарських рослин південних Філіпін як потенційний терапевтичний засіб для лікування діабету та ожиріння
DOI:
https://doi.org/10.15587/2519-4852.2025.328418Ключові слова:
Діабет 2 типу, оксидативний стрес, ожиріння, AGEs, метаболічні захворюванняАнотація
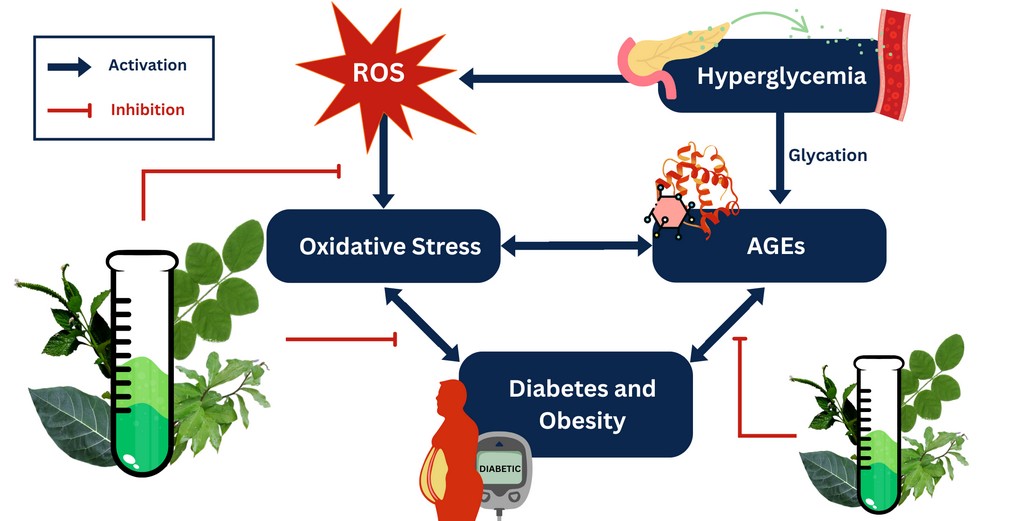
Діабет 2 типу (Д2Т) є серйозною проблемою громадського здоров'я, кількість випадків якої з роками зростає. З огляду на це, продовжується пошук дешевших та натуральних альтернатив для лікування цього захворювання. Окислювальний стрес, ожиріння та утворення кінцевих продуктів глікування (AGEs) сприяють патогенезу Д2Т.
Мета. У цьому дослідженні використовується ряд функціональних аналізів для оцінки антидіабетичної, антиоксидантної, протиожирової та антиглікаційної активності метанольних екстрактів з висушеного на повітрі листя комбінованого екстракту (CoM) Clitoria ternatea, Ficus septica, Heliotropium indicum та Celosia ignea. Крім того, було проведено кількісний скринінг для визначення наявності ключових біоактивних вторинних метаболітів, зокрема флавоноїдів та фенольних сполук.
Матеріали та методи. Для вимірювання антигіперглікемічного ефекту використовували адсорбцію глюкози та дифузію глюкози; реакції BSA білок-метилгліоксаль та BSA-глюкоза використовували як моделі для досліджень глікації; інгібування ферменту панкреатичної ліпази використовували для оцінки потенційного ліпідознижувального ефекту екстрактів зразків; а для початкової характеристики присутніх фітокомпонентів проводили кількісний фітохімічний скринінг на загальний вміст фенольних сполук та загальний вміст флавоноїдів.
Результати. У цьому дослідженні повідомлялося про здатність до адсорбції глюкози CoM при різних концентраціях (25, 50, 100 ppm), що свідчить про його потенційну антигіперглікемічну дію. З іншого боку, в аналізі дифузії глюкози in vitro було показано негативний результат (1,82±0,06 при 100 ppm) відносно контролю. CoM також продемонстрував антиоксидантну здатність через аналіз відновлення заліза та активність поглинання H2O2 (57,86±8,28 % при 25 ppm). Інгібування PPL було оцінено для позначення потенційної дії проти ожиріння, і в цьому дослідженні повідомлялося, що CoM (75 ppm) пригнічував активність ферментів на 52,13±7,16 %. Антиглікаційні тести показали, що екстракти CoM є потенційними інгібіторами утворення AGEs, оскільки він (100 ppm) пригнічував 72,23±2,71 % глікації (модель BSA-глюкоза) та 55,46±13,43 % (модель BSA-MGO). Результати фітохімічного скринінгу підтверджують представлені властивості з TPC та TFC 11,29±2,10 GAE мг/г зразка та 5,83±0,03 QE мг/г зразка відповідно.
Висновки. Загалом, комбіновані метанольні рослинні екстракти, CoM, можуть бути використані як стратегія лікування метаболічних розладів, спричинених оксидативним стресом, таких як діабет та ожиріння. Хоча проведені дослідження показали багатообіцяючі результати, необхідні подальші дослідження біоактивних сполук зразків
Посилання
- DeFronzo, R. A. (2009). From the Triumvirate to the Ominous Octet: A New Paradigm for the Treatment of Type 2 Diabetes Mellitus. Diabetes, 58 (4), 773–795. https://doi.org/10.2337/db09-9028
- Cho, N. H., Shaw, J. E., Karuranga, S., Huang, Y., da Rocha Fernandes, J. D., Ohlrogge, A. W., Malanda, B. (2018). IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045. Diabetes Research and Clinical Practice, 138, 271–281. https://doi.org/10.1016/j.diabres.2018.02.023
- Kamalakkannan, N., Prince, P. S. M. (2006). Rutin improves the antioxidant status in streptozotocin-induced diabetic rat tissues. Molecular and Cellular Biochemistry, 293 (1-2), 211–219. https://doi.org/10.1007/s11010-006-9244-1
- Kawser Hossain, M., Abdal Dayem, A., Han, J., Yin, Y., Kim, K., Kumar Saha, S. et al. (2016). Molecular Mechanisms of the Anti-Obesity and Anti-Diabetic Properties of Flavonoids. International Journal of Molecular Sciences, 17 (4), 569. https://doi.org/10.3390/ijms17040569
- International Diabetes Federation. IDF Diabetes Atlas. Available at: https://diabetesatlas.org/idfawp/resource-files/2021/07/IDF_Atlas_10th_Edition_2021.pdf Lat accessed: 04.05.2022
- Saxena, A., Vikram, N. K. (2004). Role of Selected Indian Plants in Management of Type 2 Diabetes: A Review. The Journal of Alternative and Complementary Medicine, 10 (2), 369–378. https://doi.org/10.1089/107555304323062365
- Efferth, T. (2007). Willmar Schwabe Award 2006: Antiplasmodial and Antitumor Activity of Artemisinin – From Bench to Bedside. Planta Medica, 73 (4), 299–309. https://doi.org/10.1055/s-2007-967138
- Ou, S., Kwok, K., Li, Y., Fu, L. (2001). In Vitro Study of Possible Role of Dietary Fiber in Lowering Postprandial Serum Glucose. Journal of Agricultural and Food Chemistry, 49 (2), 1026–1029. https://doi.org/10.1021/jf000574n
- Adiotomre, J., Eastwood, M., Edwards, C., Brydon, W. (1990). Dietary fiber: in vitro methods that anticipate nutrition and metabolic activity in humans. The American Journal of Clinical Nutrition, 52 (1), 128–134. https://doi.org/10.1093/ajcn/52.1.128
- Oyaizu, M. (1986). Studies on products of browning reaction. Antioxidative activities of products of browning reaction prepared from glucosamine. The Japanese Journal of Nutrition and Dietetics, 44 (6), 307–315. https://doi.org/10.5264/eiyogakuzashi.44.307
- Ruch, R. J., Cheng, S., Klaunig, J. E. (1989). Prevention of cytotoxicity and inhibition of intercellular communication by antioxidant catechins isolated from Chinese green tea. Carcinogenesis, 10 (6), 1003–1008. https://doi.org/10.1093/carcin/10.6.1003
- Kim, Y. S., Lee, Y. M., Kim, H., Kim, J., Jang, D. S., Kim, J. H., Kim, J. S. (2010). Anti-obesity effect of Morus bombycis root extract: Anti-lipase activity and lipolytic effect. Journal of Ethnopharmacology, 130 (3), 621–624. https://doi.org/10.1016/j.jep.2010.05.053
- Zheng, C.-D., Duan, Y.-Q., Gao, J.-M., Ruan, Z.-G. (2010). Screening for Anti-lipase Properties of 37 Traditional Chinese Medicinal Herbs. Journal of the Chinese Medical Association, 73 (6), 319–324. https://doi.org/10.1016/s1726-4901(10)70068-x
- Miroliaei, M., Khazaei, S., Moshkelgosha, S., Shirvani, M. (2011). Inhibitory effects of Lemon balm (Melissa officinalis, L.) extract on the formation of advanced glycation end products. Food Chemistry, 129 (2), 267–271. https://doi.org/10.1016/j.foodchem.2011.04.039
- Ni, M., Song, X., Pan, J., Gong, D., Zhang, G. (2021). Vitexin Inhibits Protein Glycation through Structural Protection, Methylglyoxal Trapping, and Alteration of Glycation Site. Journal of Agricultural and Food Chemistry, 69 (8), 2462–2476. https://doi.org/10.1021/acs.jafc.0c08052
- Folin, O., Ciocalteu, V. (1927). On tyrosine and tryptophane determinations in proteins. Journal of Biological Chemistry, 73 (2), 627–650. https://doi.org/10.1016/s0021-9258(18)84277-6
- Sánchez-Rangel, J. C., Benavides, J., Heredia, J. B., Cisneros-Zevallos, L., Jacobo-Velázquez, D. A. (2013). The Folin–Ciocalteu assay revisited: improvement of its specificity for total phenolic content determination. Analytical Methods, 5 (21), 5990. https://doi.org/10.1039/c3ay41125g
- Shraim, A. M., Ahmed, T. A., Rahman, M. M., Hijji, Y. M. (2021). Determination of total flavonoid content by aluminum chloride assay: A critical evaluation. LWT, 150, 111932. https://doi.org/10.1016/j.lwt.2021.111932
- Adiotomre, J., Eastwood, M., Edwards, C., Brydon, W. (1990). Dietary fiber: in vitro methods that anticipate nutrition and metabolic activity in humans. The American Journal of Clinical Nutrition, 52 (1), 128–134. https://doi.org/10.1093/ajcn/52.1.128
- Mary Shoba Das, C., Gayathri Devi, S. (2015). In Vitro Glucose Binding Activity of Terminalia Bellirica. Asian Journal of Pharmaceutical and Clinical Research, 8 (2), 320–323.
- Ou, S., Kwok, K., Li, Y., Fu, L. (2001). In Vitro Study of Possible Role of Dietary Fiber in Lowering Postprandial Serum Glucose. Journal of Agricultural and Food Chemistry, 49 (2), 1026–1029. https://doi.org/10.1021/jf000574n
- Poovitha, S., Parani, M. (2016). In vitro and in vivo α-amylase and α-glucosidase inhibiting activities of the protein extracts from two varieties of bitter gourd (Momordica charantia L.). BMC Complementary and Alternative Medicine, 16(S1). https://doi.org/10.1186/s12906-016-1085-1
- McCord, J. M. (2000). The evolution of free radicals and oxidative stress. The American Journal of Medicine, 108 (8), 652–659. https://doi.org/10.1016/s0002-9343(00)00412-5
- Chung, K.-T., Wong, T. Y., Wei, C.-I., Huang, Y.-W., Lin, Y. (1998). Tannins and Human Health: A Review. Critical Reviews in Food Science and Nutrition, 38 (6), 421–464. https://doi.org/10.1080/10408699891274273
- Bhatti, M. Z., Ali, A., Ahmad, A., Saeed, A., Malik, S. A. (2015). Antioxidant and phytochemical analysis of Ranunculus arvensis L. extracts. BMC Research Notes, 8 (1). https://doi.org/10.1186/s13104-015-1228-3
- Vangoori, Y., Dakshinamoorthi, A., Kavimani, S. (2019). Prominent Pancreatic Lipase Inhibition and Free Radical Scavenging Activity of a Myristica fragrans Ethanolic Extract in vitro. Potential Role in Obesity Treatment. Maedica – A Journal of Clinical Medicine, 14 (3). https://doi.org/10.26574/maedica.2019.14.3.254
- Chaput, J.-P., St-Pierre, S., Tremblay, A. (2007). Currently Available Drugs for the Treatment of Obesity: Sibutramine and Orlistat. Mini-Reviews in Medicinal Chemistry, 7 (1), 3–10. https://doi.org/10.2174/138955707779317849
- Klunk, W. E., Jacob, R. F., Mason, R. P. (1999). Quantifying Amyloid β-Peptide (Aβ) Aggregation Using the Congo Red-Aβ (CR–Aβ) Spectrophotometric Assay. Analytical Biochemistry, 266 (1), 66–76. https://doi.org/10.1006/abio.1998.2933
- Lima, M., Baynes, J. W. (2013). Glycation. Encyclopedia of Biological Chemistry. Academic Press, 405–411. https://doi.org/10.1016/b978-0-12-378630-2.00120-1
- Jeyaraj, E. J., Lim, Y. Y., Choo, W. S. (2020). Extraction methods of butterfly pea (Clitoria ternatea) flower and biological activities of its phytochemicals. Journal of Food Science and Technology, 58 (6), 2054–2067. https://doi.org/10.1007/s13197-020-04745-3
- Torres, R. C., Parcon, Ma. R. V., Esmundo, H. J. N., Canillo, D. C. P., Ramil, C. C. (2022). Antioxidant activity and phytochemical constituents of Philippine Clitoria ternatea flowers as a potential therapeutic agent against infectious diseases. Issues in Biological Sciences and Pharmaceutical Research, 10 (2). https://doi.org/10.15739/ibspr.22.003
- Fayed, M. A. A. (2021). Heliotropium; a genus rich in pyrrolizidine alkaloids: A systematic review following its phytochemistry and pharmacology. Phytomedicine Plus, 1 (2), 100036. https://doi.org/10.1016/j.phyplu.2021.100036
- Cajuday, L. A., Membreve, D. M. S., Montealegre, M. V., Serrano, J. E., Baldo, D. E. (2020). In Vitro Antidiabetic, Antiobesity and Antioxidant Activities of Selected Endemic Plants from Mount Mayon and Mount Albay, Philippines. International Journal of Biosciences, 16 (3), 635–648. http://dx.doi.org/10.12692/ijb/16.3.635-648
- Jayasri, M. A., Gunasekaran, S., Radha, A., Mathew, T. L. (2008). Anti-diabetic effect of Costus pictus leaves in normal and streptozotocin-induced diabetic rats. International Journal of Diabetes and Metabolism, 16 (3), 117–122. https://doi.org/10.1159/000497662
- Ibrahim, S. R. M., Bagalagel, A. A., Diri, R. M., Noor, A. O., Bakhsh, H. T., Mohamed, G. A. (2022). Phytoconstituents and Pharmacological Activities of Indian Camphorweed (Pluchea indica): A Multi-Potential Medicinal Plant of Nutritional and Ethnomedicinal Importance. Molecules, 27 (8), 2383. https://doi.org/10.3390/molecules27082383
- Chagas, M. do S. S., Behrens, M. D., Moragas-Tellis, C. J., Penedo, G. X. M., Silva, A. R., Gonçalves-de-Albuquerque, C. F. (2022). Flavonols and Flavones as Potential anti-Inflammatory, Antioxidant, and Antibacterial Compounds. Oxidative Medicine and Cellular Longevity, 2022, 1–21. https://doi.org/10.1155/2022/9966750
- Pathak, M. P., Pathak, K., Saikia, R., Gogoi, U., Patowary, P., Chattopadhyay, P., Das, A. (2023). Therapeutic potential of bioactive phytoconstituents found in fruits in the treatment of non-alcoholic fatty liver disease: A comprehensive review. Heliyon, 9 (4), e15347. https://doi.org/10.1016/j.heliyon.2023.e15347
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2025 Aaron L. Degamon, Misshell L. Lavilla, Orlie B. Basalo, Nesyl Mae O. Butong, Danical Necole P. Cabural, Maria Angelika M. Villarosa, Anelyn P. Bendoy, Charlie Jr. A. Lavilla

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.








