Раціональний комп’ютерний дизайн та синтез нових потенційних антигіпертензивних агентів серед 1,2,3-триазолвмісних аналогів ніфедипіну
DOI:
https://doi.org/10.15587/2519-4852.2024.291626Ключові слова:
1,4-дигідропіридин, 1,2,3-триазол, блокатори каналів кальцію, антигіпертензивні засоби, молекулярний докінг, синтезАнотація
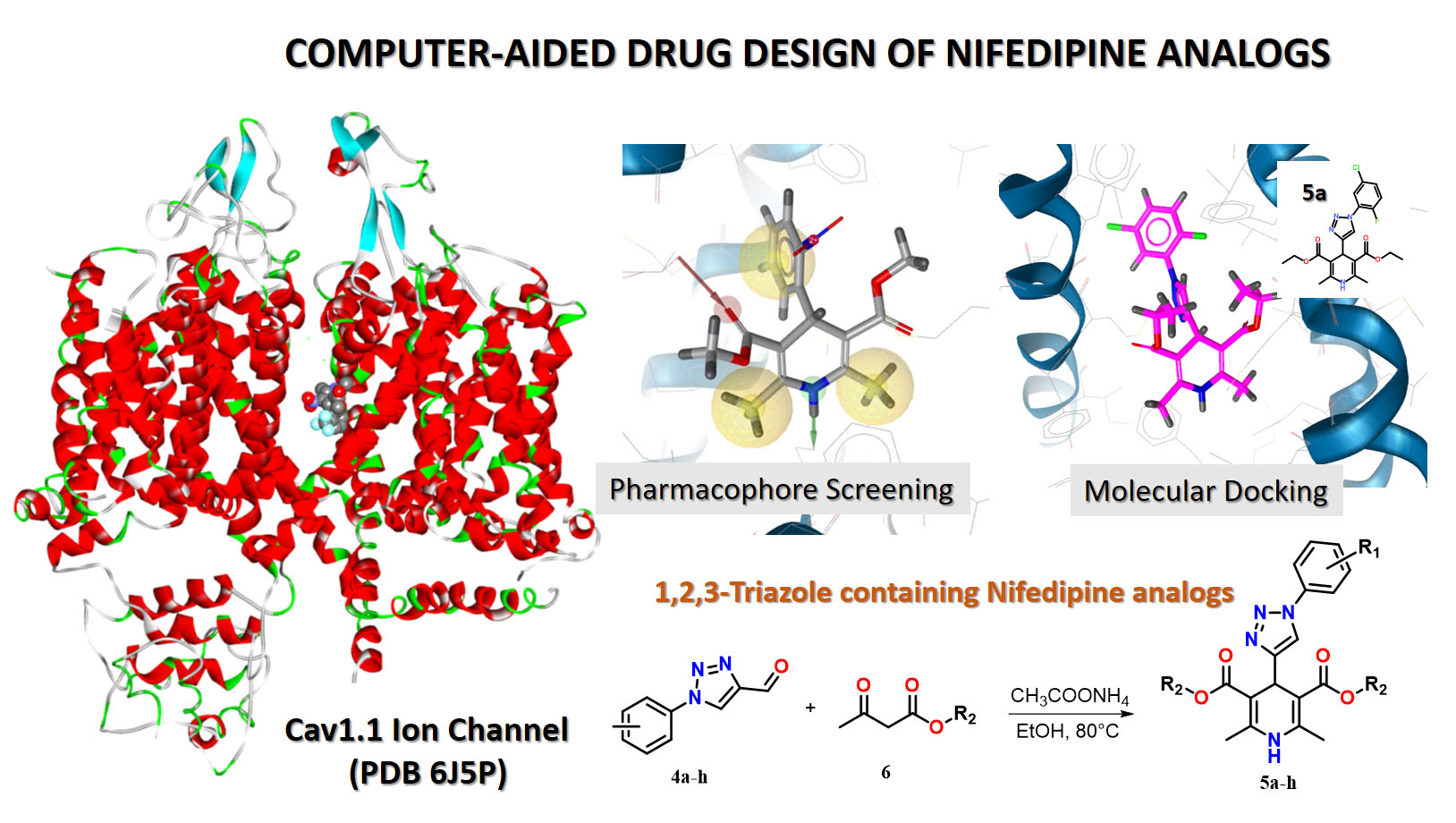
Аналоги ніфедипіну, що містять 1,2,3-триазол, дають можливість підвищити біостабільність, біодоступність, ефективність і селективність зв’язування з цільовими рецепторами. В цій роботі ми застосували комп’ютерний раціональний дизайн для ідентифікації нових аналогів ніфедипіну, що містять 1,2,3-триазоловий фрагмент. По-перше, була створена нова хімічна бібліотека з 796 похідних, що поєднують фрагмент дигідропіридину (DHP) і 1,2,3-триазольний фрагмент. По-друге, щоб зменшити розмір бібліотеки, її було попередньо відфільтровано за допомогою двох 3D-фармакофорних моделей різної складності, що дозволило нам поступово зменшити хімічний простір, у підсумку отримавши 26 хіт-кандидатів. Розрахунки молекулярного докінгу щодо рецептора rCav1.1 дозволили ідентифікувати вісім хіт-похідних 5a-h, що характеризуються спорідненістю зв’язування з рецептором rCav1.1 такого ж рівня, як і схвалені препарати, подібні до ніфедипіну. Далі наші результати молекулярного докінгу були використані для дизайну та оптимізації ретросинтетичних схем синтезу нових аналогів ніфедипіну як перспективних антигіпертензивних агентів. Нами запропоновано ретросинтетичний підхід до одержання [i]похідних 1,4-дигідропіридину з 1,2,3-триазоловим кільцем у положенні 4. Нарешті, вісім аналогів 5a-h, визначених за розрахунками молекулярного докінгу, були синтезовані за допомогою запропонованого ретросинтетичного підходу.
Мета цього дослідження полягає в виявленні нових аналогів ніфедипіну за допомогою комп’ютерного проектування лікарських засобів з використанням фармакофорного скринінгу, молекулярного докінгу та ретросинтетичного підходу.
Матеріали та методи. Комп’ютерний дизайн лікарських засобів нових DHP-похідних з використанням фармакофорного скринінгу та розрахунків молекулярного докінгу. Органічний синтез нових аналогів ніфедипіну, що містять 1,2,3-триазольний фрагмент.
Результати. Молекулярний докінг нових аналогів ніфедипіну дозволив оцінити афінність зв'язування нових похідних ніфедипіну з рецептором rCav1.1. Фармакофорний скринінг хімічної бібліотеки аналогів, що складається з 796 похідних, дозволив поступово зменшити хімічний простір, та отримати 26 кандидатів з високою спорідненістю до рецептора rCav1.1. Методом молекулярного докінгу ідентифіковано вісім похідних 5а-h, запропоновано та здійснено синтез рекомендованих сполук.
Висновки. Результати молекулярного докінгу показали, що аналоги ніфедипіну характеризуються афінністю зв’язування з рецептором rCav1.1 такого ж рівня, як і схвалені ніфедипіноподібні препарати. Фармакофорний скринінг і розрахунки молекулярного докінгу вказують на ключові особливості взаємодії ліганд-рецептор, які можуть спрямовувати та оптимізувати синтез нових аналогів ніфедипіну як нових перспективних антигіпертензивних агентів. Запропоновано ретросинтетичний підхід та здійснено синтез рекомендованих сполук
Спонсор дослідження
- This project has received funding through the MSCA4Ukraine project, which is funded by the European Union. Views and opinions expressed are however those of the author(s) only and do not necessarily reflect those of the European Union. Neither the European Union nor the MSCA4Ukraine Consortium as a whole nor any individual member institutions of the MSCA4Ukraine Consortium can be held responsible for them
Посилання
- Petkova, V., Peneva, A., Andreevska, K., Hristov, E., Grekova, D., Todorova, A. et al. (2023). Level of hypertension treatment adherence during pandemic. Pharmacia, 70 (3), 643–648. https://doi.org/10.3897/pharmacia.70.e109440
- Khedkar, S., Auti, P. (2014). 1, 4-Dihydropyridines: A Class of Pharmacologically Important Molecules. Mini-Reviews in Medicinal Chemistry, 14 (3), 282–290. https://doi.org/10.2174/1389557513666131119204126
- Parthiban, A., Parameshwar, M. (2022). 1,4-Dihydropyridine: synthetic advances, medicinal and insecticidal properties. RSC Advances, 12 (45), 29253–29290. https://doi.org/10.1039/d2ra04589c
- Wang, A. L., Iadecola, C., Wang, G. (2017). New generations of dihydropyridines for treatment of hypertension. Journal of Geriatric Cardiology, 14 (1), 67–72. https://doi.org/10.11909/j.issn.1671-5411.2017.01.006
- Zhang, Y. H., Zhang, Z. Q., Wu, Q. (1991). Synthesis of alkyl 2,6-dimethyl-(substituted or unsubstituted furyl)-1,4-dihydropyridine-3,5-dicarboxylates. Acta pharmaceutica Sinica, 26 (5), 375–378.
- Caignan, G. A., Metcalf, S. K., Holt, E. M. (2000). Thiophene substituted dihydropyridines. Journal of Chemical Crystallography, 30 (6), 415–422. https://doi.org/10.1023/a:1009538107356
- Lavilla, R., Gotsens, T., Santano, M. C., Bosch, J., Camins, A., Arnau, N. et al. (1997). Synthesis and Calcium Channel Blocking Activity of 4-Indolyl-1,4-dihydropyridines. Bioorganic Chemistry, 25 (3), 169–178. https://doi.org/10.1006/bioo.1997.1059
- Shafiee, A., Dehpour, A. R., Hadizadeh, F., Azimi, M. (1998). Syntheses and calcium channel antagonist activity of nifedipine analogues with methylsulfonylimidazolyl substituent. Pharmaceutica Acta Helvetiae, 73 (2), 75–79. https://doi.org/10.1016/s0031-6865(98)00004-1
- Nekooeian, A., Fard, S. H., Miri, R. (2016). Antihypertensive effects of new dihydropyridine derivatives on phenylephrine-raised blood pressure in rats. Research in Pharmaceutical Sciences, 11 (6), 497–504. https://doi.org/10.4103/1735-5362.194897
- Caignan, G. A., Holt, E. M. (2002). New 1,4-dihydropyridine derivatives with hetero and saturated B rings. Journal of Chemical Crystallography, 32 (9), 315–323. https://doi.org/10.1023/a:1020209608962
- Dostal, W., Heinisch, G., Holzer, W., Perhauc, I., Zheng, C. (1990). Pyridazines. LI. On the Reactivity of Pyridazine‐carbaldehydes towards Selected Active‐Hydrogen Compounds. Journal of Heterocyclic Chemistry, 27 (5), 1313–1321. https://doi.org/10.1002/jhet.5570270526
- Saini, K. K., Rani, R., Muskan, Khanna, N., Mehta, B., Kumar, R. (2023). An Overview of Recent Advances in Hantzsch’s Multicomponent Synthesis of 1,4- Dihydropyridines: A Class of Prominent Calcium Channel Blockers. Current Organic Chemistry, 27 (2), 119–129. https://doi.org/10.2174/1385272827666230403112419
- Praveenkumar, E., Gurrapu, N., Kumar Kolluri, P., Yerragunta, V., Reddy Kunduru, B., Subhashini, N. J. P. (2019). Synthesis, anti-diabetic evaluation and molecular docking studies of 4-(1-aryl-1H-1, 2, 3-triazol-4-yl)-1,4-dihydropyridine derivatives as novel 11-β hydroxysteroid dehydrogenase-1 (11β-HSD1) inhibitors. Bioorganic Chemistry, 90, 103056. https://doi.org/10.1016/j.bioorg.2019.103056
- Bajaj, S. D., Mahodaya, O. A., Tekade, P. V., Patil, V. B., Kukade, S. D. (2017). Synthesis of diethyl 4-(phenyl-substituted)-2,6-dimethyl-1,4-dihydropyridine-3,5-dicarboxylates catalyzed by CoCl2/K-10 montmorillonite in water and their antimicrobial activity. Russian Journal of General Chemistry, 87 (3), 546–549. https://doi.org/10.1134/s1070363217030264
- Lentz, F., Hemmer, M., Reiling, N., Hilgeroth, A. (2016). Discovery of novel N- phenyl 1,4-dihydropyridines with a dual mode of antimycobacterial activity. Bioorganic & Medicinal Chemistry Letters, 26 (24), 5896–5898. https://doi.org/10.1016/j.bmcl.2016.11.010
- Cateni, F., Zacchigna, M., Pedemonte, N., Galietta, L. J. V., Mazzei, M. T., Fossa, P. et al. (2009). Synthesis of 4-thiophen-2′-yl-1,4-dihydropyridines as potentiators of the CFTR chloride channel. Bioorganic & Medicinal Chemistry, 17 (23), 7894–7903. https://doi.org/10.1016/j.bmc.2009.10.028
- Kumar, R. S., Idhayadhulla, A., Abdul Nasser, A. J., Selvin, J. (2011). Synthesis and anticoagulant activity of a new series of 1,4-dihydropyridine derivatives. European Journal of Medicinal Chemistry, 46 (2), 804–810. https://doi.org/10.1016/j.ejmech.2010.12.006
- Malek, R., Maj, M., Wnorowski, A., Jóźwiak, K., Martin, H., Iriepa, I. et al. (2019). Multi-target 1,4-dihydropyridines showing calcium channel blockade and antioxidant capacity for Alzheimer’s disease therapy. Bioorganic Chemistry, 91, 103205. https://doi.org/10.1016/j.bioorg.2019.103205
- Rucins, M., Gosteva, M., Belyakov, S., Sobolev, A., Pajuste, K., Plotniece, M. et al. (2015). Evaluation of Antiradical Activity and Reducing Capacity of Synthesised Bispyridinium Dibromides Obtained by Quaternisation of 4-Pyridyl-1,4-dihydropyridines with Propargyl Bromide. Australian Journal of Chemistry, 68 (1), 86–92. https://doi.org/10.1071/ch14033
- Wolber, G., Langer, T. (2004). LigandScout: 3-D Pharmacophores Derived from Protein-Bound Ligands and Their Use as Virtual Screening Filters. Journal of Chemical Information and Modeling, 45 (1), 160–169. https://doi.org/10.1021/ci049885e
- Trott, O., Olson, A. J. (2009). AutoDock Vina: Improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading. Journal of Computational Chemistry, 31 (2), 455–461. https://doi.org/10.1002/jcc.21334
- Humphrey, W., Dalke, A., Schulten, K. (1996). VMD: Visual molecular dynamics. Journal of Molecular Graphics, 14 (1), 33–38. https://doi.org/10.1016/0263-7855(96)00018-5
- Zhao, Y., Huang, G., Wu, J., Wu, Q., Gao, S., Yan, Z. et al. (2019). Molecular Basis for Ligand Modulation of a Mammalian Voltage-Gated Ca2+ Channel. Cell, 177 (6), 1495–1506.e12. https://doi.org/10.1016/j.cell.2019.04.043
- Dolphin, A. C. (2006). A short history of voltage‐gated calcium channels. British Journal of Pharmacology, 147 (S1), S56–S62. https://doi.org/10.1038/sj.bjp.0706442
- Lohachova, K. O., Sviatenko, A. S., Kyrychenko, A., Ivanov, V. V., Langer, T., Kovalenko, S. M., Kalugin, O. N. (2024). Computer-aided drug design of novel nirmatrelvir analogs inhibiting main protease of Coronavirus SARS-CoV-2. Journal of Applied Pharmaceutical Science, 14 (5), 232–239. https://doi.org/10.7324/japs.2024.158114
- Sander, T., Freyss, J., von Korff, M., Rufener, C. (2015). DataWarrior: An Open-Source Program For Chemistry Aware Data Visualization And Analysis. Journal of Chemical Information and Modeling, 55 (2), 460–473. https://doi.org/10.1021/ci500588j
- Li, W., Zhou, X., Luan, Y., Wang, J. (2015). Direct access to 1,4-disubstituted 1,2,3-triazoles through organocatalytic 1,3-dipolar cycloaddition reaction of α,β-unsaturated esters with azides. RSC Advances, 5 (108), 88816–88820. https://doi.org/10.1039/c5ra19038j
- Yu, D., Hu, F., Zhang, Y., Zheng, X., Kuang, C., Yang, Q. (2013). Synthesis and Biological Activity of Novel Deoxynojirimycin Derivatives as Potent α-Glucosidase Inhibitors. Zeitschrift Für Naturforschung B, 68 (4), 383–390. https://doi.org/10.5560/znb.2013-2318
- Calvino-Casilda, V., Martín-Aranda, R. M. (2020). Ordered mesoporous molecular sieves as active catalyts for the synthesis of 1,4-dihydropyridine derivatives. Catalysis Today, 354, 44–50. https://doi.org/10.1016/j.cattod.2019.06.046
- Siddiqui, M. M., Nagargoje, A. A., Raza, A. K., Pisal, P. M., Shingate, B. B. (2022). [Et3NH][HSO4] catalyzed solvent‐free synthesis of new 1,2,3‐triazolidene‐indolinone derivatives. Journal of Heterocyclic Chemistry, 59 (5), 899–908. https://doi.org/10.1002/jhet.4429
- Deshmukh, T. R., Krishna, V. S., Sriram, D., Sangshetti, J. N., Shingate, B. B. (2019). Synthesis and bioevaluation of α,α’-bis(1H-1,2,3-triazol-5-ylmethylene) ketones. Chemical Papers, 74 (3), 809–820. https://doi.org/10.1007/s11696-019-00908-5
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Alexander Kyrychenko, Igor Bylov, Anna Geleverya, Sergiy Kovalenko, Iryna Zhuravel, Volodymyr Fetyukhin, Thierry Langer

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.







