Поліморфізм CYP2C19 в результаті лікування есциталопрамом у популяції Південної Індії з важким депресивним розладом
DOI:
https://doi.org/10.15587/2519-4852.2024.307289Ключові слова:
важкий депресивний розлад, ефективність, безпека, есциталопрам, генотип, фенотипАнотація
Різні групи метаболітів, опосередкованих CYP2C19, можуть виникнути внаслідок міжіндивідуальної мінливості, що потенційно впливає на ефективність і безпеку есциталопраму. Отже, надзвичайно важливо створити повний збір інформації, що стосується кожного фенотипу щодо ефективності та переносимості терапії. Це дозволить психіатрам приймати оптимальні рішення для окремих пацієнтів.
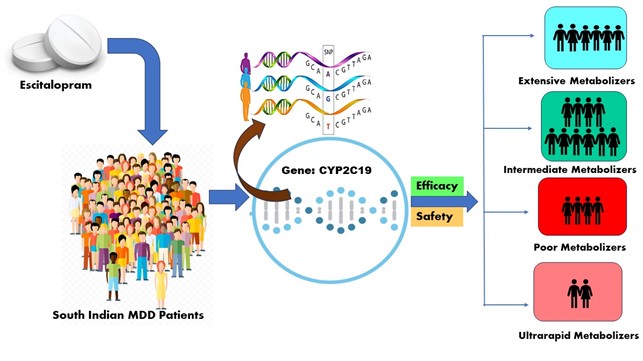
Мета дослідження: Метою цього дослідження є класифікація пацієнтів з ВДР на різні групи метаболізаторів CYP2C19 і визначення зв’язку між фенотипом і результатом лікування.
Матеріали та методи: У дослідженні взяли участь 119 пацієнтів із ВДР, які отримували монотерапію есциталопрамом, віком 18–58 років. MADRS, HDRS-17 і CGI використовувалися для вимірювання ефективності на початковому етапі, після 4, 8 і 12 тижнів. Результати щодо безпеки та переносимості досліджувалися на основі побічних реакцій. Клінічні результати порівнювали за фенотипом на основі змін у HDRS-17 та оцінках CGI з 4 по 12 тиждень.
Результати: Суб’єкти були класифіковані за генотипом CYP2C19: 20 із низьким (PM), 64 з проміжним (IM), 24 з інтенсивним (EM) та 11 із надшвидким (UM) метаболітами. Відповідь і ремісія відбулися у 67,2 % і 26,8 % із 119 пацієнтів наприкінці 12-го тижня дослідження. Рівень відповідей у PM був значно нижчим (21,6 %) порівняно з EM. Було зареєстровано 312 побічних реакцій (ПР), і 88 (73,94 %) осіб мали принаймні одну. У даних про безпеку нервозність була найпоширенішою побічної реакцією серед чотирьох груп у 66 осіб (55,4 %), наступним за поширеністю було зниження апетиту у 48 суб’єктів (40,3 %). Серйозних побічних реакцій не було. Чоловіки мали більше побічних реакцій, ніж жінки.
Висновки: Генотипування CYP2C19 може допомогти персоналізувати препарат есциталопрам. Дослідження показало, що знижена здатність ПМ метаболізувати есциталопрам, ймовірно, пов’язана зі зниженою ефективністю та толерантністю, виявленими при ПМ, порівняно з ЕМ та ІМ. Зв’язок між статусом метаболіста та відповіддю на лікування слідував очікуваному напрямку. Наші висновки повинні ґрунтуватися на майбутніх клінічних дослідженнях, які включають оцінку фармакокінетики
Посилання
- Sadock, B. J., Sadock, V. A., Ruiz, P. (2015). Mood disorders. Kaplan and Sadock’s synopsis of psychiatry: Behavioural sciences/Clinical psychiatry. Indian Journal of Psychiatry, 11, 347–350.
- Arvind, B. A., Gururaj, G., Loganathan, S., Amudhan, S., Varghese, M., Benegal, V. et al. (2019). Prevalence and socioeconomic impact of depressive disorders in India: multisite population-based cross-sectional study. BMJ Open, 9 (6), e027250. https://doi.org/10.1136/bmjopen-2018-027250
- Dhar, A. K., Barton, D. A. (2016). Depression and the link with cardiovascular disease. Front Psychiatry, 7. https://doi.org/10.3389/fpsyt.2016.00033
- Xin, L.-M., Chen, L., Su, Y.-A., Yang, F.-D., Wang, G., Fang, Y.-R. et al. (2018). Risk Factors for Recent Suicide Attempts in Major Depressive Disorder Patients in China: Results From a National Study. Frontiers in Psychiatry, 9. https://doi.org/10.3389/fpsyt.2018.00300
- Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study (2017). Lancet, 392 (10159), 1789–1858.
- Mathers, C. D., Loncar, D. (2006). Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med, 3 (11), 2011–2030. https://doi.org/10.1371/journal.pmed.0030442
- Maity, N., Ghosal, M. K., Gupta, A., Sil, A., Chakraborty, S., Chatterjee, S. (2014). Clinical effectiveness and safety of escitalopram and desvenlafaxine in patients of depression with anxiety: A randomized, open-label controlled trial. Indian Journal of Pharmacology, 46, 433–437. https://doi.org/10.4103/0253-7613.135959
- Uckun, Z., Baskak, B., Ozel-Kizil, E. T., Ozdemir, H., Ozguven, H. D., Suzen, H. S. (2015). The impact of CYP2C19 polymorphisms on citalopram metabolism in patients with major depressive disorder. Journal of Clinical Pharmacy and Therapeutics, 40 (6), 672–679. https://doi.org/10.1111/jcpt.12320
- Spina, E., De Leon, J. (2015). Clinical applications of CYP genotyping in psychiatry. Journal of Neural Transmission, 122 (1), 5–28. https://doi.org/10.1007/s00702-014-1300-5
- He, Q., Yuan, Z., Liu, Y., Zhang, J., Yan, H., Shen, L. et al. (2017). Correlation between cytochrome P450 2C19 genetic polymorphism and treatment response to escitalopram in panic disorder. Pharmacogenetics and Genomics, 27 (8), 279–284. https://doi.org/10.1097/fpc.0000000000000290
- Hicks, J., Bishop, J., Sangkuhl, K., Müller, D., Ji, Y., Leckband, S. et al. (2015). Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for CYP2D6 and CYP2C19 Genotypes and Dosing of Selective Serotonin Reuptake Inhibitors. Clinical Pharmacology & Therapeutics, 98 (2), 127–134. https://doi.org/10.1002/cpt.147
- Zhou, H.-H. (2002). Genetic polymorphism of CYP2C19 in Chinese ethnic populations. International Congress Series, 1244, 51–61. https://doi.org/10.1016/s0531-5131(02)00455-7
- Horai, Y., Nakano, M., Ishizaki, T. (1989). Metoprolol and mephenytoin oxidation polymorphisms in Far Eastern Oriental subjects: Japanese versus mainland Chinese. Clinical Pharmacology and Therapeutics, 46, 198–207. https://doi.org/10.1038/clpt.1989.126
- Yu, B. N., Chen, G. L., He, N., Ouyang, D.-S., Chen, X.-P., Liu, Z.-Q. (2003). Pharmacokinetics of citalopram in relation to genetic polymorphism of CYP2C19. Drug Metabolism and Disposition, 31, 1255–1259. https://doi.org/10.1124/dmd.31.10.1255
- Rudberg, I., Mohebi, B., Hermann, M., Refsum, H., Molden, E. (2008). Impact of the ultrarapid CYP2C19*17 allele on serum concentration of escitalopram in psychiatric patients. Clinical Pharmacology & Therapeutics, 83, 322–327. https://doi.org/10.1038/sj.clpt.6100291
- Anderson, I. M. (1998). SSRIs versus tricyclic antidepressants in depressed inpatients: A meta-analysis of efficacy and tolerability. Depression and Anxiety, 7 (S1), 11–17. https://doi.org/10.1002/(sici)1520-6394(1998)7:1+<11::aid-da4>3.0.co;2-i
- Wilkinson, G. R. (2005). Drug Metabolism and Variability among Patients in Drug Response. New England Journal of Medicine, 352 (21), 2211–2221. https://doi.org/10.1056/nejmra032424
- Rosen, R. C., Lane, R. G., Menza, M. (1999). Effects of SSRIs on sexual function: A critical review. Journal of Clinical Psychopharmacology, 19, 67–85. https://doi.org/10.1097/00004714-199902000-00013
- Trivedi, M. H., Rush, A. J., Wisniewski, S. R., Nierenberg, A. A., Warden, D., Ritz, L. et al. (2006). Evaluation of Outcomes With Citalopram for Depression Using Measurement-Based Care in STAR*D: Implications for Clinical Practice. American Journal of Psychiatry, 163 (1), 28–40. https://doi.org/10.1176/appi.ajp.163.1.28
- Ng, C., Sarris, J., Singh, A., Bousman, C., Byron, K., Peh, L. H. et al. (2013). Pharmacogenetic polymorphisms and response to escitalopram and venlafaxine over 8 weeks in major depression. Human Psychopharmacology: Clinical and Experimental, 28, 516–522. https://doi.org/10.1002/hup.2340
- Hodgson, K., Tansey, K., Dernovšek, M. Z., Hauser, J., Henigsberg, N., Maier, W. et al. (2013). Genetic differences in cytochrome P450 enzymes and antidepressant treatment response. Journal of Psychopharmacology, 28 (2), 133–141. https://doi.org/10.1177/0269881113512041
- Chang, M., Tybring, G., Dahl, M.-L., Lindh, J. D. (2014). Impact of Cytochrome P450 2C19 Polymorphisms on Citalopram/Escitalopram Exposure: A Systematic Review and Meta-Analysis. Clinical Pharmacokinetics, 53 (9), 801–811. https://doi.org/10.1007/s40262-014-0162-1
- Jukić, M. M., Haslemo, T., Molden, E., Ingelman-Sundberg, M. (2018). Impact of CYP2C19 Genotype on Escitalopram Exposure and Therapeutic Failure: A Retrospective Study Based on 2,087 Patients. American Journal of Psychiatry, 175 (5), 463–470. https://doi.org/10.1176/appi.ajp.2017.17050550
- Caudle, K. E., Dunnenberger, H. M., Freimuth, R. R., Peterson, J. F., Burlison, J. D., Whirl-Carrillo, M. et al. (2017). Standardizing terms for clinical pharmacogenetic test results: consensus terms from the Clinical Pharmacogenetics Implementation Consortium (CPIC). Genetics in Medicine, 19 (2), 215–223. https://doi.org/10.1038/gim.2016.87
- Lingjærde, O., Ahlfors, U. G., Bech, P., Dencker, S. J., Elgen, K. (1987). The UKU side effect rating scale: A new comprehensive rating scale for psychotropic drugs and a cross‐sectional study of side effects in neuroleptic‐treated patients. Acta Psychiatrica Scandinavica, 76 (s334), 1–100. https://doi.org/10.1111/j.1600-0447.1987.tb10566.x
- Huezo-Diaz, P., Perroud, N., Spencer, E. P., Smith, R., Sim, S., Virding, S. et al. (2011). CYP2C19 genotype predicts steady state escitalopram concentration in GENDEP. Journal of Psychopharmacology, 26 (3), 398–407. https://doi.org/10.1177/0269881111414451
- Rudberg, I., Hermann, M., Refsum, H., Molden, E. (2008). Serum concentrations of sertraline and N-desmethyl sertraline in relation to CYP2C19 genotype in psychiatric patients. European Journal of Clinical Pharmacology, 64 (12), 1181–1188. https://doi.org/10.1007/s00228-008-0533-3
- Aynacioglu, A., Sachse, C., Bozkurt, A., Kortunay, S., Nacak, M., Schroder, T. et al. (1999). Low frequency of defective alleles of cytochrome P450 enzymes 2C19 and 2D6 in the Turkish population. Clinical Pharmacology & Therapeutics, 66 (2), 185–192. https://doi.org/10.1053/cp.1999.v66.100072001
- Pinto, C., Trivedi, J. K., Vankar, G. K., Sharma, P. S., Narasimha, V. (2007). An open-label multicentric study of the tolerability and response to escitalopram treatment in Indian patients with major depressive disorder. Journal of Indian Medical Association, 105 (7), 364–368.
- Strumila, R., Lengvenyte, A., Ambrozaityte, L., Balkeliene, D., Utkus, A., Dlugauskas, E. (2021). CYP2C19 polymorphisms are associated with severity of depression at initial evaluation and after the treatment independently of the prescribed medications: 4 weeks prospective study. Psychiatric Genetics, 31 (5), 177–185. https://doi.org/10.1097/ypg.0000000000000287
- Yin, O. Q., Wing, Y.-K., Cheung, Y., Wang, Z.-J., Lam, S.-L., Chiu, H. F., Chow, M. S. (2006). Phenotype-genotype Relationship and Clinical Effects of Citalopram in Chinese Patients. Journal of Clinical Psychopharmacology, 26 (4), 367–372. https://doi.org/10.1097/01.jcp.0000227355.54074.14
- Fabbri, C., Tansey, K. E., Perlis, R. H., Hauser, J., Henigsberg, N., Maier, W. et al. (2018). Effect of cytochrome CYP2C19 metabolizing activity on antidepressant response and side effects: mMeta-analysis of data from genome-wide association studies. European Neuropsychopharmacology, 28 (8), 945–954. https://doi.org/10.1016/j.euroneuro.2018.05.009
- Goethe, J. W., Woolley, S. B., Cardoni, A. A., Woznicki, B. A., Piez, D. A. (2007). Selective Serotonin Reuptake Inhibitor Discontinuation: side effects and other factors that influence medication adherenc. Journal of Clinical Psychopharmacology, 27 (5), 451–458. https://doi.org/10.1097/jcp.0b013e31815152a5
- Tsai, M. H., Lin, K. M., Hsiao, M. C., Shen, W. W., Lu, M. L., Tang, H. S. et al. (2010). Genetic polymorphisms of cytochrome P450 enzymes influence metabolism of the antidepressant escitalopram and treatment response. Pharmacogenomics, 11 (4), 537–546. https://doi.org/10.2217/pgs.09.168
- Singh, A. B., Bousman, C. A., Ng, C. H., Byron, K., Berk, M. (2012). ABCB1 polymorphism predicts escitalopram dose needed for remission in major depression. Translational Psychiatry, 27 (2), e198. https://doi.org/10.1038/tp.2012.115
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 B Jeevan Kumar, Vijayakumar Thangavel Mahalingam, Ganesh Kumar

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Наше видання використовує положення про авторські права Creative Commons CC BY для журналів відкритого доступу.








