Thiazolidinone-based compounds as dual-purpose therapeutics: antimicrobial efficacy, cytotoxicity and pharmacokinetic potential
DOI:
https://doi.org/10.15587/2519-4852.2025.342467Keywords:
antimicrobial activity, cytotoxicity, pharmacokinetics, molecular docking, molecular dynamics, thiazolidinone, ProTox IIAbstract
Infectious diseases and cancer remain leading global health challenges, with rising resistance to existing antibiotics and limited selectivity of many cytotoxic agents. Heterocyclic scaffolds, particularly thiazolidinones, offer a promising platform for the development of novel antimicrobial and anticancer compounds.
The aim of the study. To evaluate the antimicrobial and cytotoxic properties of thiazolidinone-based compounds against a panel of pathogenic microorganisms and human cancer cell lines, and to identify the most promising derivatives with favorable safety, pharmacokinetic, and mechanistic profiles through molecular docking and dynamics studies.
Materials and methods. A library of 5-enamine(hydrazine)-4-thiazolidinone derivatives was screened for antimicrobial activity against Gram-positive and Gram-negative bacteria and Candida albicans, and for cytotoxic activity against six human cancer cell lines. Minimum inhibitory concentrations (MIC) were determined, and IC₅₀ values were measured for selected compounds. Pharmacokinetic properties, including gastrointestinal absorption and lipophilicity, were assessed in silico. To investigate potential mechanisms of antibacterial action, molecular docking was performed against MurB (UDP-N-acetylenolpyruvylglucosamine reductase) and DNA gyrase subunit B (ATPase domain), followed by molecular dynamics (MD) simulations to evaluate the stability of the most promising complexes.
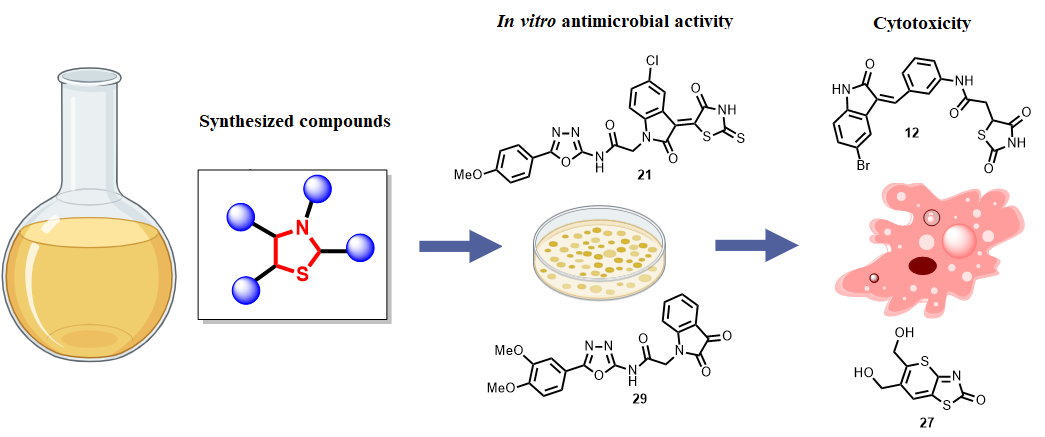
Results. Thirty-two compounds exhibited antimicrobial activity (MIC ≤ 200 µM), and ten (6, 7, 10, 12, 13, 16, 19, 21, 22, and 29) were identified as the most active. Compound 29, an isatin–oxadiazole hybrid, demonstrated potent activity against Enterococcus faecalis and vancomycin-resistant E. faecium (MIC = 3.13 µM), outperforming vancomycin. Compound 21 was highly active against Staphylococcus epidermidis (MIC = 1.56 µM), while compound 6 showed efficacy against methicillin-susceptible and -resistant S. aureus (MIC = 6.25 µM). Moderate antifungal activity was observed for compound 27 (MIC = 100 µM), whereas Gram-negative bacteria were largely resistant. Cytotoxicity screening revealed selective anticancer activity of compounds 12 and 27, with high therapeutic indices against CCRF-CEM cells and minimal effects on normal fibroblasts. Compound 2 exhibited strong cytotoxicity (IC₅₀ = 1.1 µM), while compound 29 combined non-cytotoxicity with favorable pharmacokinetic characteristics.
Molecular docking supported MurB as the primary antibacterial target, with the most active compounds (21 and 29) showing the most favorable binding energies. Compound 29 also exhibited strong affinity for GyrB, indicating a potential dual-target mechanism. Molecular dynamics confirmed that MurB–compound 29 complexes were particularly stable, correlating well with experimental antibacterial activity.
Conclusions. Thiazolidinone-based hybrids demonstrated promising antimicrobial and anticancer properties. Compound 29 emerged as a particularly attractive dual-purpose candidate due to its potent activity, safety profile, favorable pharmacokinetics, and validated interaction with essential bacterial enzymes. Together, biological and computational results support the potential of thiazolidinone scaffolds as a basis for the development of selective or multitarget therapeutic agents
Supporting Agencies
- National Research Foundation of Ukraine under project number 2023.05/0021
- Scientific (research and development) project under number 0125U003375
- Projects IGA_LF_2024_034 and IGA_LF_2024_038
- National Institute of Virology and Bacteriology project (Program EXCELES, ID Project No. LX22NPO5103)
- European Union–Next Generation EU
References
- Singh, K. S., Anand, S., Dholpuria, S., Sharma, J. K., Blankenfeldt, W., Shouche, Y. (2021). Antimicrobial resistance dynamics and the one-health strategy: a review. Environmental Chemistry Letters, 19 (4), 2995–3007. https://doi.org/10.1007/s10311-021-01238-3
- Roy, S., Sarkhel, S., Bisht, D., Hanumantharao, S. N., Rao, S., Jaiswal, A. (2022). Antimicrobial mechanisms of biomaterials: from macro to nano. Biomaterials Science, 10 (16), 4392–4423. https://doi.org/10.1039/d2bm00472k
- Church, N. A., McKillip, J. L. (2021). Antibiotic resistance crisis: challenges and imperatives. Biologia, 76 (5), 1535–1550. https://doi.org/10.1007/s11756-021-00697-x
- Grant, E. B., Guiadeen, D., Baum, E. Z., Foleno, B. D., Jin, H., Montenegro, D. A. et al. (2000). The synthesis and SAR of rhodanines as novel class C β-lactamase inhibitors. Bioorganic & Medicinal Chemistry Letters, 10 (19), 2179–2182. https://doi.org/10.1016/s0960-894x(00)00444-3
- Suree, N., Yi, S. W., Thieu, W., Marohn, M., Damoiseaux, R., Chan, A. et al. (2009). Discovery and structure–activity relationship analysis of Staphylococcus aureus sortase A inhibitors. Bioorganic & Medicinal Chemistry, 17 (20), 7174–7185. https://doi.org/10.1016/j.bmc.2009.08.067
- Howard, M. H., Cenizal, T., Gutteridge, S., Hanna, W. S., Tao, Y., Totrov, M. et al. (2004). A Novel Class of Inhibitors of Peptide Deformylase Discovered through High-Throughput Screening and Virtual Ligand Screening. Journal of Medicinal Chemistry, 47 (27), 6669–6672. https://doi.org/10.1021/jm049222o
- Carlson, E. E., May, J. F., Kiessling, L. L. (2006). Chemical Probes of UDP-Galactopyranose Mutase. Chemistry & Biology, 13 (8), 825–837. https://doi.org/10.1016/j.chembiol.2006.06.007
- Sim, M. M., Ng, S. B., Buss, A. D., Crasta, S. C., Goh, K. L., Lee, S. K. (2002). Benzylidene Rhodanines as Novel Inhibitors of UDP-N-Acetylmuramate/l-Alanine Ligase. Bioorganic & Medicinal Chemistry Letters, 12 (4), 697–699. https://doi.org/10.1016/s0960-894x(01)00832-0
- Smith, T. K., Young, B. L., Denton, H., Hughes, D. L., Wagner, G. K. (2009). First small molecular inhibitors of T. brucei dolicholphosphate mannose synthase (DPMS), a validated drug target in African sleeping sickness. Bioorganic & Medicinal Chemistry Letters, 19 (6), 1749–1752. https://doi.org/10.1016/j.bmcl.2009.01.083
- Vicini, P., Geronikaki, A., Anastasia, K., Incerti, M., Zani, F. (2006). Synthesis and antimicrobial activity of novel 2-thiazolylimino-5-arylidene-4-thiazolidinones. Bioorganic & Medicinal Chemistry, 14 (11), 3859–3864. https://doi.org/10.1016/j.bmc.2006.01.043
- Horishny, V., Kartsev, V., Geronikaki, A., Matiychuk, V., Petrou, A., Glamoclija, J. et al. (2020). 5-(1H-Indol-3-ylmethylene)-4-oxo-2-thioxothiazolidin-3-yl)alkancarboxylic Acids as Antimicrobial Agents: Synthesis, Biological Evaluation, and Molecular Docking Studies. Molecules, 25 (8), 1964. https://doi.org/10.3390/molecules25081964
- Soltero-Higgin, M., Carlson, E. E., Phillips, J. H., Kiessling, L. L. (2004). Identification of Inhibitors for UDP-Galactopyranose Mutase. Journal of the American Chemical Society, 126 (34), 10532–10533. https://doi.org/10.1021/ja048017v
- Lozynskyi, A., Zasidko, V., Atamanyuk, D., Kaminskyy, D., Derkach, H., Karpenko, O. et al. (2017). Synthesis, antioxidant and antimicrobial activities of novel thiopyrano[2,3-d]thiazoles based on aroylacrylic acids. Molecular Diversity, 21 (2), 427–436. https://doi.org/10.1007/s11030-017-9737-8
- Habib, N. S., Rida, S. M., Badawey, E. A. M., Fahmy, H. T. Y. (1996). Condensed thiazoles, I: Synthesis of 5,7-disubstituted thiazolo[4,5-d]pyrimidines as possible anti-HIV, anticancer, and antimicrobial agents. Monatshefte für Chemie Chemical Monthly, 127 (11), 1203–1207. https://doi.org/10.1007/bf00844696
- Mahfouz, Aziz, A. A., Elhabashy, F. M. (1990). New synthesis of 2-substituted imidazo[2,1-b]thiazoles and their antimicrobial activities. Archives of Pharmacal Research, 13 (1), 9–13. https://doi.org/10.1007/bf02857826
- Lozynskyi, A., Konechnyi, Y., Senkiv, J., Yushyn, I., Khyluk, D., Karpenko, O. et al. (2021). Synthesis and Biological Activity Evaluation of Novel 5-Methyl-7-phenyl-3H-thiazolo[4,5-b]pyridin-2-ones. Scientia Pharmaceutica, 89 (4), 52. https://doi.org/10.3390/scipharm89040052
- Khamitova, А., Berillo, D., Lozynskyi, A., Konechnyi, Y., Mural, D., Georgiyants, V., Lesyk, R. (2024). Thiadiazole and Thiazole Derivatives as Potential Antimicrobial Agents. Mini-Reviews in Medicinal Chemistry, 24 (5), 531–545. https://doi.org/10.2174/1389557523666230713115947
- Currie, G. M. (2018). Pharmacology, Part 1: Introduction to Pharmacology and Pharmacodynamics. Journal of Nuclear Medicine Technology, 46 (2), 81–86. https://doi.org/10.2967/jnmt.117.199588
- Shepeta, Y., Lozynskyi, A., Sulyma, M., Nektegayev, I., Grellier, P., Lesyk, R. (2020). Synthesis and biological activity evaluation of new thiazolidinone-diclofenac hybrid molecules. Phosphorus, Sulfur, and Silicon and the Related Elements, 195 (10), 836–841. https://doi.org/10.1080/10426507.2020.1759060
- Kryshchyshyn, A., Kaminskyy, D., Karpenko, O., Gzella, A., Grellier, P., Lesyk, R. (2019). Thiazolidinone/thiazole based hybrids – New class of antitrypanosomal agents. European Journal of Medicinal Chemistry, 174, 292–308. https://doi.org/10.1016/j.ejmech.2019.04.052
- Sklyarova, Y., Fomenko, I., Lozynska, I., Lozynskyi, A., Lesyk, R., Sklyarov, A. (2017). Hydrogen Sulfide Releasing 2-Mercaptoacrylic Acid-Based Derivative Possesses Cytoprotective Activity in a Small Intestine of Rats with Medication-Induced Enteropathy. Scientia Pharmaceutica, 85 (4), 35. https://doi.org/10.3390/scipharm85040035
- Holota, S., Kryshchyshyn, A., Derkach, H., Trufin, Y., Demchuk, I., Gzella, A. et al. (2019). Synthesis of 5-enamine-4-thiazolidinone derivatives with trypanocidal and anticancer activity. Bioorganic Chemistry, 86, 126–136. https://doi.org/10.1016/j.bioorg.2019.01.045
- Zelisko, N., Atamanyuk, D., Ostapiuk, Y., Bryhas, A., Matiychuk, V., Gzella, A., Lesyk, R. (2015). Synthesis of fused thiopyrano[2,3-d][1,3]thiazoles via hetero-Diels–Alder reaction related tandem and domino processes. Tetrahedron, 71 (50), 9501–9508. https://doi.org/10.1016/j.tet.2015.10.019
- Kryshchyshyn, A., Kaminskyy, D., Nektegayev, I., Grellier, P., Lesyk, R. (2018). Isothiochromenothiazoles – A Class of Fused Thiazolidinone Derivatives with Established Anticancer Activity That Inhibits Growth of Trypanosoma brucei brucei. Scientia Pharmaceutica, 86 (4), 47. https://doi.org/10.3390/scipharm86040047
- Lozynskyi, A., Zimenkovsky, B., Lesyk, R. (2014). Synthesis and Anticancer Activity of New Thiopyrano[2,3-d]thiazoles Based on Cinnamic Acid Amides. Scientia Pharmaceutica, 82 (4), 723–733. https://doi.org/10.3797/scipharm.1408-05
- Konechnyi, Y. T., Lozynskyi, A. V., Horishny, V. Ya., Konechna, R. T., Vynnytska, R. B., Korniychuk, O. P., Lesyk, R. B. (2020). Synthesis of indoline-thiazolidinone hybrids with antibacterial and antifungal activities. Biopolymers and Cell, 36 (5), 381–391. https://doi.org/10.7124/bc.000a3a
- SwissADME online server of the Swiss Institute of Bioinformatics. Available at: http://www.swissadme.ch/index.php
- Banerjee, P., Eckert, A. O., Schrey, A. K., Preissner, R. (2018). ProTox-II: a webserver for the prediction of toxicity of chemicals. Nucleic Acids Research, 46 (W1), W257–W263. https://doi.org/10.1093/nar/gky318
- Kamiloglu, S., Sari, G., Ozdal, T., Capanoglu, E. (2020). Guidelines for cell viability assays. Food Frontiers, 1 (3), 332–349. https://doi.org/10.1002/fft2.44
- Markossian, S., Coussens, N. P., Dahlin, J. L., Sitta Sittampalam, G. (2021). Assay Guidance Manual for Drug Discovery: Technologies That Matter. SLAS Technology, 26 (6), 553–554. https://doi.org/10.1177/24726303211056338
- Borková, L., Frydrych, I., Jakubcová, N., Adámek, R., Lišková, B., Gurská, S. et al. (2020). Synthesis and biological evaluation of triterpenoid thiazoles derived from betulonic acid, dihydrobetulonic acid, and ursonic acid. European Journal of Medicinal Chemistry, 185, 111806. https://doi.org/10.1016/j.ejmech.2019.111806
- Jurášek, M., Řehulka, J., Hrubá, L., Ivanová, A., Gurská, S., Mokshyna, O. et al. (2023). Triazole-based estradiol dimers prepared via CuAAC from 17α-ethinyl estradiol with five-atom linkers causing G2/M arrest and tubulin inhibition. Bioorganic Chemistry, 131, 106334. https://doi.org/10.1016/j.bioorg.2022.106334
- EUCAST: Clinical breakpoints and dosing of antibiotics (2024). European Committee on Antimicrobial Susceptibility Testing, & European Committee on Antimicrobial Susceptibility Testing.
- Andres, C. J., Bronson, J. J., D’Andrea, S. V., Deshpande, M. S., Falk, P. J., Grant-Young, K. A. et al. (2000). 4-Thiazolidinones: novel inhibitors of the bacterial enzyme murB. Bioorganic & Medicinal Chemistry Letters, 10 (8), 715–717. https://doi.org/10.1016/s0960-894x(00)00073-1
- Ahmed, S., Zayed, M., El-Messery, S., Al-Agamy, M., Abdel-Rahman, H. (2016). Design, Synthesis, Antimicrobial Evaluation and Molecular Modeling Study of 1,2,4-Triazole-Based 4-Thiazolidinones. Molecules, 21 (5), 568. https://doi.org/10.3390/molecules21050568
- Pitta, E., Tsolaki, E., Geronikaki, A., Petrović, J., Glamočlija, J., Soković, M. et al. (2015). 4-Thiazolidinone derivatives as potent antimicrobial agents: microwave-assisted synthesis, biological evaluation and docking studies. MedChemComm, 6 (2), 319–326. https://doi.org/10.1039/c4md00399c
- Jakopin, Ž., Ilaš, J., Barančoková, M., Brvar, M., Tammela, P., Sollner Dolenc, M. et al. (2017). Discovery of substituted oxadiazoles as a novel scaffold for DNA gyrase inhibitors. European Journal of Medicinal Chemistry, 130, 171–184. https://doi.org/10.1016/j.ejmech.2017.02.046
- Song, F., Li, Z., Bian, Y., Huo, X., Fang, J., Shao, L., Zhou, M. (2020). Indole/isatin‐containing hybrids as potential antibacterial agents. Archiv Der Pharmazie, 353 (10). https://doi.org/10.1002/ardp.202000143
- Yang, Y.-S., Su, M.-M., Xu, J.-F., Liu, Q.-X., Bai, L.-F., Hu, X.-W., Zhu, H.-L. (2019). Discovery of novel oxoindolin derivatives as atypical dual inhibitors for DNA Gyrase and FabH. Bioorganic Chemistry, 93, 103309. https://doi.org/10.1016/j.bioorg.2019.103309
- Benson, T. E., Harris, M. S., Choi, G. H., Cialdella, J. I., Herberg, J. T., Martin, J. P., Baldwin, E. T. (2001). A Structural Variation for MurB: X-ray Crystal Structure of Staphylococcus aureus UDP-N-Acetylenolpyruvylglucosamine Reductase (MurB). Biochemistry, 40 (8), 2340–2350. https://doi.org/10.1021/bi002162d
- Ronkin, S. M., Badia, M., Bellon, S., Grillot, A.-L., Gross, C. H., Grossman, T. H. et al. (2010). Discovery of pyrazolthiazoles as novel and potent inhibitors of bacterial gyrase. Bioorganic & Medicinal Chemistry Letters, 20 (9), 2828–2831. https://doi.org/10.1016/j.bmcl.2010.03.052
- Bronson, J. J., DenBleyker, K. L., Falk, P. J., Mate, R. A., Ho, H.-T., Pucci, M. J., Snyder, L. B. (2003). Discovery of the first antibacterial small molecule inhibitors of MurB. Bioorganic & Medicinal Chemistry Letters, 13 (5), 873–875. https://doi.org/10.1016/s0960-894x(02)01076-4
- Hanwell, M. D., Curtis, D. E., Lonie, D. C., Vandermeersch, T., Zurek, E., Hutchison, G. R. (2012). Avogadro: an advanced semantic chemical editor, visualization, and analysis platform. Journal of Cheminformatics, 4 (1). https://doi.org/10.1186/1758-2946-4-17
- Halgren, T. A. (1999). MMFF VII. Characterization of MMFF94, MMFF94s, and other widely available force fields for conformational energies and for intermolecular-interaction energies and geometries. Journal of Computational Chemistry, 20 (7), 730–748. https://doi.org/10.1002/(sici)1096-987x(199905)20:7<730::aid-jcc8>3.0.co;2-t
- Morris, G. M., Huey, R., Olson, A. J. (2008). Using AutoDock for Ligand‐Receptor Docking. Current Protocols in Bioinformatics, 24 (1). https://doi.org/10.1002/0471250953.bi0814s24
- Eberhardt, J., Santos-Martins, D., Tillack, A. F., Forli, S. (2021). AutoDock Vina 1.2.0: New Docking Methods, Expanded Force Field, and Python Bindings. Journal of Chemical Information and Modeling, 61 (8), 3891–3898. https://doi.org/10.1021/acs.jcim.1c00203
- Agarwal, R., Smith, J. C. (2023). Speed vs Accuracy: Effect on Ligand Pose Accuracy of Varying Box Size and Exhaustiveness in AutoDock Vina. Molecular Informatics, 42 (2). https://doi.org/10.1002/minf.202200188
- Van Der Spoel, D., Lindahl, E., Hess, B., Groenhof, G., Mark, A. E., Berendsen, H. J. C. (2005). GROMACS: Fast, flexible, and free. Journal of Computational Chemistry, 26 (16), 1701–1718. https://doi.org/10.1002/jcc.20291
- Wang, J., Wolf, R. M., Caldwell, J. W., Kollman, P. A., Case, D. A. (2004). Development and testing of a general amber force field. Journal of Computational Chemistry, 25 (9), 1157–1174. https://doi.org/10.1002/jcc.20035
- Guex, N., Peitsch, M. C. (1997). SWISS‐MODEL and the Swiss‐Pdb Viewer: An environment for comparative protein modeling. Electrophoresis, 18 (15), 2714–2723. https://doi.org/10.1002/elps.1150181505
- Rekha, S. R., Kulandhaivel, M., Hridhya, K. V. (2018). Antibacterial Efficacy and Minimum Inhibitory Concentrations of Medicinal Plants Against Wound Pathogens. Biomedical and Pharmacology Journal, 11 (1), 237–246. https://doi.org/10.13005/bpj/1368
- Tangadanchu, V. K. R., Sui, Y.-F., Zhou, C.-H. (2021). Isatin-derived azoles as new potential antimicrobial agents: Design, synthesis and biological evaluation. Bioorganic & Medicinal Chemistry Letters, 41, 128030. https://doi.org/10.1016/j.bmcl.2021.128030
- Cheerala, V. S. K., Akhir, A., Saxena, D., Maitra, R., Chopra, S., Neelakantan, S. C. (2023). Discovery of benzoxazole–thiazolidinone hybrids as promising antibacterial agents against Staphylococcus aureus and Enterococcus species. RSC Medicinal Chemistry, 14 (9), 1712–1721. https://doi.org/10.1039/d3md00290j
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2025 Dmytro Mural, Dmytro Khyluk, Andrii Lozynskyi, Victoriya Georgiyants, Olexandra Roman, Anna Kryshchyshyn-Dylevych, Sona Gurska, Pavel Polishchuk, Petr Dzubak, Marian Hajduch, Katerina Bogdanova, Kristyna Resova, Milan Kolar, Roman Lesyk

This work is licensed under a Creative Commons Attribution 4.0 International License.
Our journal abides by the Creative Commons CC BY copyright rights and permissions for open access journals.







