Механізм перекалібрування рН по розчиненому кисню у лужній модифікованій аквакультурній воді
DOI:
https://doi.org/10.15587/1729-4061.2022.266012Ключові слова:
аераційна обробка, молекулярний механізм, розчинений кисень, рекалібрування рН, морська вода аквакультуриАнотація
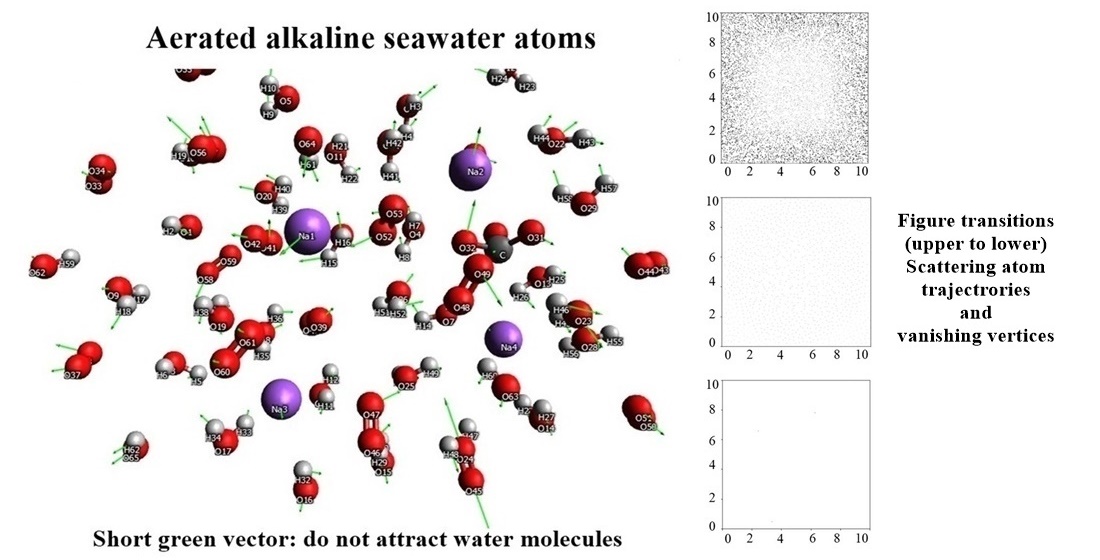
Баланс розчиненого кисню та рівня pH має першорядне значення в аквакультурі як середовищі для вирощування водних організмів у контрольованих умовах. Дисбаланс як кисню, так і рН, може серйозно пошкодити водні організми, що культивуються. Для запобігання гіпоксії та підтримці рівня pH культури використовуються різні стратегії. Цікаво, що гіпоксія чи позбавлення постачання киснем, в аквакультурі часто супроводжувалися підкисленням морської води. Незважаючи на це, не було жодних доказів того, що рівень O2 був безпосередньо пов’язаний із змінами рН. Таким чином, існуючі стратегії очищення розділені між підтримкою O2 та pH, що часто призводить до завищення вартості та створює навантаження на навколишнє середовище через використання синтетичних хімікатів. Це дослідження було проведено для вивчення механізму та ефекту додавання O2 до морської води для аквакультури на молекулярному рівні при зміні значення pH води. Розуміння механізму може призвести до альтернативи шкідливим методам обробки аквакультури. Молекулярномеханічний аналіз був застосований для вивчення механізму регулювання рН у неаерованій та аерованій морській воді. Результати показали, що O2 прискорює повторне калібрування pH морської води, особливо у зразках, модифікованих лугом, порівняно зі зразками, модифікованими кислотою. Механічне моделювання також показало, що відштовхування між O2 і викликає вібрацію, яка вкорочує зв’язок OH на 17,71 %, а зв’язок OO подовжується на 1,00 %. Крім того, спиновий зв'язок між OH та O2 сприяє глобальному перенесення енергії, що стимулює вібрацію лужномодифікованої водної системи. Водночас, ці механізми дозволили значенню pH повернутися до вихідного рівня. Ці результати сприяють уявленню про молекулярний механізм підтримки pH в аквакультурі в присутності O2, а також перегляд використання аерації при обробці аквакультури
Спонсор дослідження
- The authors are deeply grateful to Yogita A. D. Susanti, Zulkisam Pramudia, Abdul Azis Amin, and Adi Tiya Yanuar from Microbial Resources and Biotechnology research group of the Postgraduate School of Brawijaya University for their assistance.
Посилання
- Henriksson, P. J. G., Tran, N., Mohan, C. V., Chan, C. Y., Rodriguez, U.-P., Suri, S. et. al. (2017). Indonesian aquaculture futures – Evaluating environmental and socioeconomic potentials and limitations. Journal of Cleaner Production, 162, 1482–1490. doi: https://doi.org/10.1016/j.jclepro.2017.06.133
- Rimmer, M. A., Larson, S., Lapong, I., Purnomo, A. H., Pong-Masak, P. R., Swanepoel, L., Paul, N. A. (2021). Seaweed Aquaculture in Indonesia Contributes to Social and Economic Aspects of Livelihoods and Community Wellbeing. Sustainability, 13 (19), 10946. doi: https://doi.org/10.3390/su131910946
- Zhang, P., Zhang, X., Li, J., Huang, G. (2006). The effects of body weight, temperature, salinity, pH, light intensity and feeding condition on lethal DO levels of whiteleg shrimp, Litopenaeus vannamei (Boone, 1931). Aquaculture, 256 (1-4), 579–587. doi: https://doi.org/10.1016/j.aquaculture.2006.02.020
- Thulasi, D., Muralidhar, M., Saraswathy, R. (2020). Effect of sulphide in Pacific white shrimp Penaeus vannamei under varying oxygen and pH levels. Aquaculture Research, 51 (6), 2389–2399. doi: https://doi.org/10.1111/are.14582
- Chan, F., Barth, J., Kroeker, K., Lubchenco, J., Menge, B. (2019). The Dynamics and Impact of Ocean Acidification and Hypoxia: Insights from Sustained Investigations in the Northern California Current Large Marine Ecosystem. Oceanography, 32 (3), 62–71. doi: https://doi.org/10.5670/oceanog.2019.312
- Zeebe, R. E. (2012). History of Seawater Carbonate Chemistry, Atmospheric CO2, and Ocean Acidification. Annual Review of Earth and Planetary Sciences, 40 (1), 141–165. doi: https://doi.org/10.1146/annurev-earth-042711-105521
- Anggayasti, W. L., Mancera, R. L., Bottomley, S., Helmerhorst, E. (2017). The self-association of HMGB1 and its possible role in the binding to DNA and cell membrane receptors. FEBS Letters, 591 (2), 282–294. doi: https://doi.org/10.1002/1873-3468.12545
- Ulaje, S. A., Lluch-Cota, S. E., Sicard, M. T., Ascencio, F., Cruz-Hernández, P., Racotta, I. S., Rojo-Arreola, L. (2020). Litopenaeus vannamei oxygen consumption and HSP gene expression at cyclic conditions of hyperthermia and hypoxia. Journal of Thermal Biology, 92, 102666. doi: https://doi.org/10.1016/j.jtherbio.2020.102666
- Sultana, T., Haque, M., Salam, M., Alam, M. (2017). Effect of aeration on growth and production of fish in intensive aquaculture system in earthen ponds. Journal of the Bangladesh Agricultural University, 15 (1), 113–122. doi: https://doi.org/10.3329/jbau.v15i1.33536
- Tanveer, M., Roy, S. M., Vikneswaran, M., Renganathan, P., Balasubramanian, P. (2018). Surface aeration systems for application in aquaculture: A review. International Journal of Fisheries and Aquatic Studies, 6 (5), 342–347. Available at: https://www.fisheriesjournal.com/archives/2018/vol6issue5/PartE/6-5-23-591.pdf
- Wang, X., Shang, Y., Kong, H., Hu, M., Yang, J., Deng, Y., Wang, Y. (2020). Combined effects of ocean acidification and hypoxia on the early development of the thick shell mussel Mytilus coruscus. Helgoland Marine Research, 74 (1). doi: https://doi.org/10.1186/s10152-020-0535-9
- Sylvain, F.-É., Cheaib, B., Llewellyn, M., Gabriel Correia, T., Barros Fagundes, D. et. al. (2016). pH drop impacts differentially skin and gut microbiota of the Amazonian fish tambaqui (Colossoma macropomum). Scientific Reports, 6 (1). doi: https://doi.org/10.1038/srep32032
- George, M. N., Andino, J., Huie, J., Carrington, E. (2019). Microscale pH and Dissolved Oxygen Fluctuations within Mussel Aggregations and Their Implications for Mussel Attachment and Raft Aquaculture. Journal of Shellfish Research, 38 (3), 795. doi: https://doi.org/10.2983/035.038.0329
- Carstensen, J., Duarte, C. M. (2019). Drivers of pH Variability in Coastal Ecosystems. Environmental Science & Technology, 53 (8), 4020–4029. doi: https://doi.org/10.1021/acs.est.8b03655
- Hlordzi, V., Kuebutornye, F. K. A., Afriyie, G., Abarike, E. D., Lu, Y., Chi, S., Anokyewaa, M. A. (2020). The use of Bacillus species in maintenance of water quality in aquaculture: A review. Aquaculture Reports, 18, 100503. doi: https://doi.org/10.1016/j.aqrep.2020.100503
- Irawan, Y., Fonda, H., Sabna, E., Febriani, A. (2021). Intelligent Quality Control of Shrimp Aquaculture Based On Real-Time System and IoT Using Mobile Device. International Journal of Engineering Trends and Technology, 69 (4), 49–56. doi: https://doi.org/10.14445/22315381/ijett-v69i4p208
- Diez, A. (2021). SiSyPHE: A Python package for the Simulation of Systems of interacting mean-field Particles with High Efficiency. Journal of Open Source Software, 6 (65), 3653. doi: https://doi.org/10.21105/joss.03653
- D’Orsogna, M. R., Chuang, Y. L., Bertozzi, A. L., Chayes, L. S. (2006). Self-Propelled Particles with Soft-Core Interactions: Patterns, Stability, and Collapse. Physical Review Letters, 96 (10). doi: https://doi.org/10.1103/physrevlett.96.104302
- Ahmed, A. A. M. (2017). Prediction of dissolved oxygen in Surma River by biochemical oxygen demand and chemical oxygen demand using the artificial neural networks (ANNs). Journal of King Saud University - Engineering Sciences, 29 (2), 151–158. doi: https://doi.org/10.1016/j.jksues.2014.05.001
- Minaev, B. F. (2017). Spin-orbit coupling mechanism of singlet oxygen a1Δg quenching by solvent vibrations. Chemical Physics, 483-484, 84–95. doi: https://doi.org/10.1016/j.chemphys.2016.11.012
- Hosoya, A., Maruyama, K., Shikano, Y. (2015). Operational derivation of Boltzmann distribution with Maxwell’s demon model. Scientific Reports, 5 (1). doi: https://doi.org/10.1038/srep17011
- Hua, Z., Tian, C., Qiu, Z., Li, Y., Tian, X., Wang, M., Li, E. (2018). An investigation on NO2 sensing mechanism and shielding behavior of WO3 nanosheets. Sensors and Actuators B: Chemical, 259, 250–257. doi: https://doi.org/10.1016/j.snb.2017.12.016
- Golse, F. (2016). On the Dynamics of Large Particle Systems in the Mean Field Limit. Lecture Notes in Applied Mathematics and Mechanics, 1–144. doi: https://doi.org/10.1007/978-3-319-26883-5_1
- Miles, C. E., Zhu, J., Mogilner, A. (2022). Mechanical Torque Promotes Bipolarity of the Mitotic Spindle Through Multi-centrosomal Clustering. Bulletin of Mathematical Biology, 84 (2). doi: https://doi.org/10.1007/s11538-021-00985-2
- Grozdanov, S., Schalm, K., Scopelliti, V. (2019). Kinetic theory for classical and quantum many-body chaos. Physical Review E, 99 (1). doi: https://doi.org/10.1103/physreve.99.012206
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2022 Wresti L. Anggayasti, Willy Satrio N., I Nyoman Gede Wardana, Andi Kurniawan

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Закріплення та умови передачі авторських прав (ідентифікація авторства) здійснюється у Ліцензійному договорі. Зокрема, автори залишають за собою право на авторство свого рукопису та передають журналу право першої публікації цієї роботи на умовах ліцензії Creative Commons CC BY. При цьому вони мають право укладати самостійно додаткові угоди, що стосуються неексклюзивного поширення роботи у тому вигляді, в якому вона була опублікована цим журналом, але за умови збереження посилання на першу публікацію статті в цьому журналі.
Ліцензійний договір – це документ, в якому автор гарантує, що володіє усіма авторськими правами на твір (рукопис, статтю, тощо).
Автори, підписуючи Ліцензійний договір з ПП «ТЕХНОЛОГІЧНИЙ ЦЕНТР», мають усі права на подальше використання свого твору за умови посилання на наше видання, в якому твір опублікований. Відповідно до умов Ліцензійного договору, Видавець ПП «ТЕХНОЛОГІЧНИЙ ЦЕНТР» не забирає ваші авторські права та отримує від авторів дозвіл на використання та розповсюдження публікації через світові наукові ресурси (власні електронні ресурси, наукометричні бази даних, репозитарії, бібліотеки тощо).
За відсутності підписаного Ліцензійного договору або за відсутністю вказаних в цьому договорі ідентифікаторів, що дають змогу ідентифікувати особу автора, редакція не має права працювати з рукописом.
Важливо пам’ятати, що існує і інший тип угоди між авторами та видавцями – коли авторські права передаються від авторів до видавця. В такому разі автори втрачають права власності на свій твір та не можуть його використовувати в будь-який спосіб.









