Адаптація апарату Стадієра для електрофорезу основних протеїнів молока
DOI:
https://doi.org/10.15587/1729-4061.2024.296753Ключові слова:
апарат для електрофорезу, казеїнові фракції, протеїни сироватки молока, електрофоретичні системиАнотація
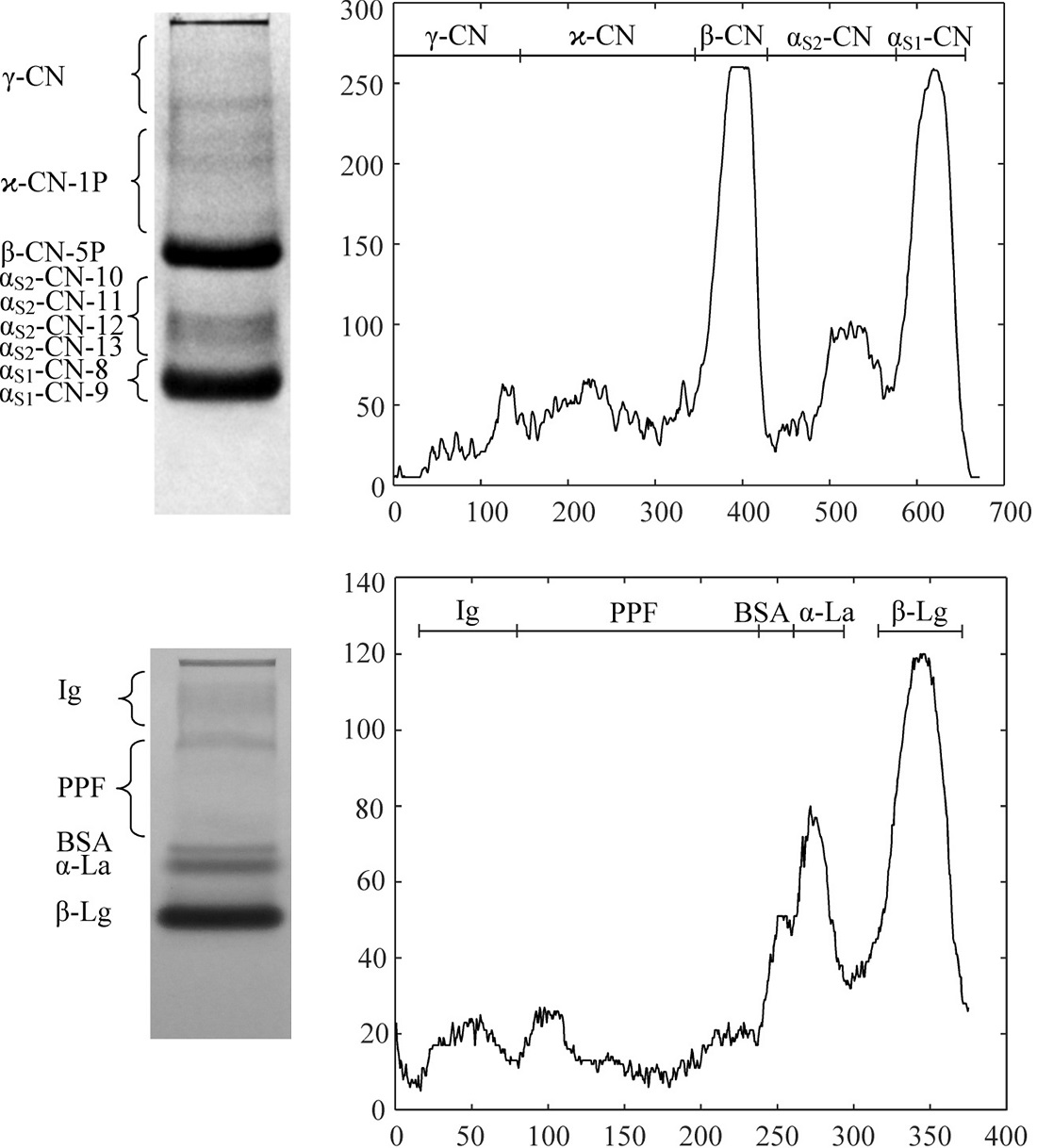
Об’єктом дослідження є апарат типу Стадієра для аналітичного електрофорезу протеїнів. При дослідженні протеїнів молока, окрім цього, виникає необхідність проведення серійних експрес-аналізів різних їх груп, а також виділення окремих гомогенних фракцій. Для вирішення цього питання були запропоновані розміри робочих камер для аналітичного, експрес- і мікропрепаративного електрофорезу казеїнів і сироватки молока. Для кожного виду електрофорезу використовуються різні камери і формери без зміни конструкції апарату. Апарат підходить для електрофоретичних систем, які використовуються для аналізу протеїнів молока. Аналіз казеїну в анодній системі однорідного поліакриламідного гелю в присутності сечовини дозволяє ідентифікувати основні фракції: αS1-CN-8P, αS1-CN-9P, αS2-CN-10P, αS2-CN-11P, αS2-CN-12P, αS2-CN-13P, β-CN-5P, ϰ-CN-1P і три фрагменти β-казеїну f(29-209), f(106-209) і f(108-209). Експрес-електрофорез у присутності сечовини виявляє чотири фракції казеїнів: αS1-CN, αS2-CN, β-CN і ϰ-CN. Аналіз протеїнів сироватки в нативній системі диск-електрофорезу Девіса дозволяє ідентифікувати фракції β-Lg A, β-Lg B, α-La, BSA і групу фракцій імуноглобулінів. Експрес-електрофореграма відрізняється спільною смугою А і В варіантів β-Lg. Завдяки адекватному підбору електрофоретичних систем можна в аналітичному або експрес-режимі ідентифікувати напівкількісно всі основні фракції протеїнів молока. Адаптований апарат також дозволяє провести мікропрепаративний електрофорез. При цьому вихід електрофоретично чистих протеїнів становить: β-CN-5P (23±5 %), β-Lg (A+B) (27±6 %), α-La (11±3 %) і очищених груп αS1-CN-8P+αS1-CN-9P (25±6 %), αS2-CN-(10-13P) (6±1,5 %) і ϰ-CN-1P (7±2 %). Апарат може застосовуватися на підприємствах з виробництва молочних білкових продуктів
Посилання
- Fox, P. F., Uniacke-Lowe, T., McSweeney, P. L. H., O’Mahony, J. A. (2015). Dairy Chemistry and Biochemistry. Springer, 584. https://doi.org/10.1007/978-3-319-14892-2
- Yukalo, V. H. (2021). Biolohichna aktyvnist proteiniv i peptydiv moloka. Ternopil: Vyd-vo TNTU imeni Ivana Puliuia, 372, 372. Available at: http://elartu.tntu.edu.ua/handle/lib/36801
- Kukhtyn, M., Vichko, O., Kravets, O., Karpyk, H., Shved, O., Novikov, V. (2019). Biochemical and microbiological changes during fermentation and storage of a fermented milk product prepared with Tibetan Kefir Starter. Archivos Latinoamericanos de Nutrición, 68 (4), 336–343. https://doi.org/10.37527/2018.68.4.007
- Kukhtyn, M., Salata, V., Horiuk, Y., Kovalenko, V., Ulko, L., Prosyanуi, S. et al. (2021). The influence of the denitrifying strain of Staphylococcus carnosus No. 5304 on the content of nitrates in the technology of yogurt production. Potravinarstvo Slovak Journal of Food Sciences, 15, 66–73. https://doi.org/10.5219/1492
- Minorova, A., Romanchuk, I., Verbytskyi, S., Danylenko, S., Krushelnytska, N., Potemska, O., Narizhnyi, S. (2022). Effect of protein and carbohydrate components upon quality parameters and viable probiotic bacteria content in milk mixtures during their drying and storage. Journal of Microbiology, Biotechnology and Food Sciences, e3778. https://doi.org/10.55251/jmbfs.3778
- Slyvka, I., Tsisaryk, O., Musii, L., Kushnir, I., Koziorowski, M., Koziorowska, A. (2022). Identification and Investigation of properties of strains Enterococcus spp. Isolated from artisanal Carpathian cheese. Biocatalysis and Agricultural Biotechnology, 39, 102259. https://doi.org/10.1016/j.bcab.2021.102259
- Musiy, L., Tsisaryk, O., Slyvka, I., Mykhaylytska, O., Gutyj, B. (2017). Research into probiotic properties of cultured butter during storing. Eastern-European Journal of Enterprise Technologies, 3 (11 (87)), 31–36. https://doi.org/10.15587/1729-4061.2017.103539
- Sharma, N., Sharma, R., Rajput, Y. S., Mann, B., Singh, R., Gandhi, K. (2021). Separation methods for milk proteins on polyacrylamide gel electrophoresis: Critical analysis and options for better resolution. International Dairy Journal, 114, 104920. https://doi.org/10.1016/j.idairyj.2020.104920
- Duarte-Vázquez, M. A., García-Ugalde, C. R., Álvarez, B. E., Villegas, L. M., García-Almendárez, B. E. et al. (2018). Use of urea-polyacrylamide electrophoresis for discrimination of A1 and A2 beta casein variants in raw cow’s milk. Journal of Food Science and Technology, 55 (5), 1942–1947. https://doi.org/10.1007/s13197-018-3088-z
- Hinz, K., O’Connor, P. M., Huppertz, T., Ross, R. P., Kelly, A. L. (2012). Comparison of the principal proteins in bovine, caprine, buffalo, equine and camel milk. Journal of Dairy Research, 79 (2), 185–191. https://doi.org/10.1017/s0022029912000015
- Yukalo, V., Datsyshyn, K., Storozh, L. (2019). Electrophoretic system for express analysis of whey protein fractions. Eastern-European Journal of Enterprise Technologies, 2 (11 (98)), 37–44. https://doi.org/10.15587/1729-4061.2019.160186
- Nollet, L. M. L., Toldra, F. (Eds.) (2009). Handbook of Dairy Foods Analysis. CRC Press. https://doi.org/10.1201/9781420046328
- Farrell, H. M., Jimenez-Flores, R., Bleck, G. T., Brown, E. M., Butler, J. E., Creamer, L. K. et al. (2004). Nomenclature of the Proteins of Cows’ Milk—Sixth Revision. Journal of Dairy Science, 87 (6), 1641–1674. https://doi.org/10.3168/jds.s0022-0302(04)73319-6
- Iukalo, А. V. (2015). Identification of protein fractions of milk cows casein complex. The Ukrainian Biochemical Journal, 87 (4), 87–91. https://doi.org/10.15407/ubj87.04.087
- Iukalo, A. V. (2014). New Approach for Isolation of Individual Caseins from Cow Milk by the Preparative Electrophoresis. Advances in Biological Chemistry, 04 (06), 382–387. https://doi.org/10.4236/abc.2014.46043
- Nurup, C. N., Czárán, T. L., Rattray, F. P. (2020). A chromatographic approach to understanding the plasmin-plasminogen system in acid whey. International Dairy Journal, 106, 104705. https://doi.org/10.1016/j.idairyj.2020.104705
- Qian, F., Sun, J., Cao, D., Tuo, Y., Jiang, S., Mu, G. (2017). Experimental and Modelling Study of the Denaturation of Milk Protein by Heat Treatment. Korean Journal for Food Science of Animal Resources, 37 (1), 44–51. https://doi.org/10.5851/kosfa.2017.37.1.44
- Yukalo, A., Yukalo, V., Shynkaryk, M. (2009). Electrophoretic separation of the milk protein. Proceeding of the International Conference on Bio and Food Electrotechnologies, 227–231.
- Pesic, M., Barac, M., Vrvic, M., Ristic, N., Macej, O., Stanojevic, S. (2011). Qualitative and quantitative analysis of bovine milk adulteration in caprine and ovine milks using native-PAGE. Food Chemistry, 125 (4), 1443–1449. https://doi.org/10.1016/j.foodchem.2010.10.045
- Yukalo, V., Datsyshyn, K., Krupa, O., Pavlistova, N. (2019). Obtaining of β-LG, α-LA and BSA protein fractions from milk whey. Ukrainian Food Journal, 8 (4), 788–798. https://doi.org/10.24263/2304-974x-2019-8-4-10
- Raak, N., Abbate, R., Lederer, A., Rohm, H., Jaros, D. (2018). Size Separation Techniques for the Characterisation of Cross-Linked Casein: A Review of Methods and Their Applications. Separations, 5 (1), 14. https://doi.org/10.3390/separations5010014
- Yukalo, V. G. (2005). Obtaining of casein protein complex fractions from cow milk. Nutracos, 5, 7–19.
- Studier, F. W. (1965). Sedimentation studies of the size and shape of DNA. Journal of Molecular Biology, 11 (2), 373–390. https://doi.org/10.1016/s0022-2836(65)80064-x
- Choveaux, D., Krause, R. G. E., Goldring, J. P. D. (2012). Rapid Detection of Proteins in Polyacrylamide Electrophoresis Gels with Direct Red 81 and Amido Black. Protein Electrophoresis, 585–589. https://doi.org/10.1007/978-1-61779-821-4_53
- Mao, X. Y., Tong, P. S., Gualco, S., Vink, S. (2012). Effect of NaCl addition during diafiltration on the solubility, hydrophobicity, and disulfide bonds of 80% milk protein concentrate powder. Journal of Dairy Science, 95 (7), 3481–3488. https://doi.org/10.3168/jds.2011-4691
##submission.downloads##
Опубліковано
Як цитувати
Номер
Розділ
Ліцензія
Авторське право (c) 2024 Volodymy Yukalo, Kateryna Datsyshyn, Olha Krupa, Liudmyla Storozh

Ця робота ліцензується відповідно до Creative Commons Attribution 4.0 International License.
Закріплення та умови передачі авторських прав (ідентифікація авторства) здійснюється у Ліцензійному договорі. Зокрема, автори залишають за собою право на авторство свого рукопису та передають журналу право першої публікації цієї роботи на умовах ліцензії Creative Commons CC BY. При цьому вони мають право укладати самостійно додаткові угоди, що стосуються неексклюзивного поширення роботи у тому вигляді, в якому вона була опублікована цим журналом, але за умови збереження посилання на першу публікацію статті в цьому журналі.
Ліцензійний договір – це документ, в якому автор гарантує, що володіє усіма авторськими правами на твір (рукопис, статтю, тощо).
Автори, підписуючи Ліцензійний договір з ПП «ТЕХНОЛОГІЧНИЙ ЦЕНТР», мають усі права на подальше використання свого твору за умови посилання на наше видання, в якому твір опублікований. Відповідно до умов Ліцензійного договору, Видавець ПП «ТЕХНОЛОГІЧНИЙ ЦЕНТР» не забирає ваші авторські права та отримує від авторів дозвіл на використання та розповсюдження публікації через світові наукові ресурси (власні електронні ресурси, наукометричні бази даних, репозитарії, бібліотеки тощо).
За відсутності підписаного Ліцензійного договору або за відсутністю вказаних в цьому договорі ідентифікаторів, що дають змогу ідентифікувати особу автора, редакція не має права працювати з рукописом.
Важливо пам’ятати, що існує і інший тип угоди між авторами та видавцями – коли авторські права передаються від авторів до видавця. В такому разі автори втрачають права власності на свій твір та не можуть його використовувати в будь-який спосіб.









